Корзина пуста.
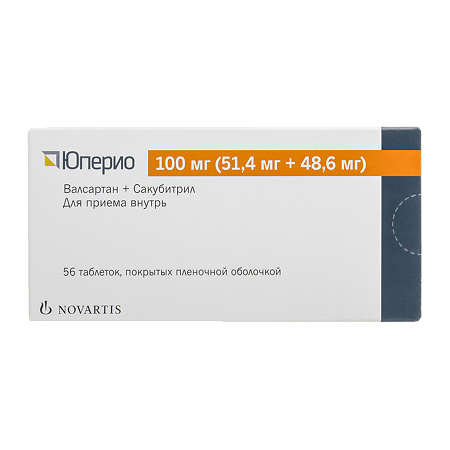
Юперио, 100 мг 56 шт
€90.27 €78.24
Описание
Фармакотерапевтическая группа: не присвоена.
Код АТХ: C09DX04.
Фармакологические свойства
Механизм действия
Действие препарата Юперио опосредовано новым механизмом, а именно, одновременным подавлением активности неприлизина (нейтральной эндопептидазы (neutral endopeptidase, NEP)) сакубитрилатом (активным метаболитом сакубитрила) и блокадой рецепторов к ангиотензину II 1-го типа (AT1) валсартаном, являющимся антагонистом рецепторов ангиотензина II (АРА II).
Под влиянием сакубитрилата происходит увеличение количества пептидов, разрушаемых неприлизином (таких как натрийуретические пептиды (НУП)), что при одновременном подавлении негативных эффектов ангиотензина II валсартаном обуславливает взаимодополняющие благоприятные эффекты сакубитрила и валсартана на состояние сердечно-сосудистой системы и почек у пациентов с сердечной недостаточностью. НУП активируют мембраносвязанные рецепторы, сопряженные с гуанилилциклазой, что приводит к повышению концентрации циклического гуанозинмонофосфата (цГМФ), вызывающего симптомы вазодилатации, увеличение натрийуреза и диуреза, увеличение скорости клубочковой фильтрации и почечного кровотока, подавление высвобождения ренина и альдостерона, снижение симпатической активности, а также антигипертрофическое и антифибротическое действие.
Валсартан, избирательно блокируя AT1-рецептор, подавляет негативные эффекты ангиотензина II на сердечно-сосудистую систему и почки, а также блокирует ангиотензин II-зависимое высвобождение альдостерона. Это предотвращает стойкую активацию ренин-ангиотензин-альдостероновой системы (РААС), которая вызывает сужение сосудов, задержку натрия и воды почками, активацию роста и пролиферацию клеток, а также последующее дезадаптивное ремоделирование сердечно-сосудистой системы.
Фармакодинамика
Фармакодинамические эффекты комплекса сакубитрила и валсартана, входящих в состав препарата, оценивали после его однократного и многократного применения у здоровых добровольцев, а также у пациентов с хронической сердечной недостаточностью. Отмечающиеся эффекты соответствовали механизму действия комплекса действующих веществ, состоящем в одновременном ингибировании неприлизина и блокаде РААС.
В 7-дневном исследовании у пациентов со сниженной фракцией выброса (ФВ) левого желудочка, в котором валсартан применяли в качестве контроля, применение комплекса сакубитрила и валсартана приводило к статистически значимому кратковременному увеличению натрийуреза, увеличению концентрации цГМФ в моче и снижению концентрации среднерегионального предшественника предсердного натрийуретического пептида (MR-proANP) и N-концевого фрагмента предшественника мозгового натрийуретического пептида (NT-proBNP) в плазме крови (по сравнению с валсартаном). В 21-дневном исследовании у пациентов со сниженной ФВ левого желудочка применение сакубитрила и валсартана вызывало статистически значимое увеличение концентрации предсердного натрийуретического пептида (ANP) и цГМФ в моче и концентрации цГМФ в плазме крови, а также снижение плазменных концентраций NT-proBNP, альдостерона и эндотелина-1 (по сравнению с исходным состоянием).
Кроме того, применение комплекса сакубитрила и валсартана блокирует AT1-рецептор, на что указывает увеличение активности и концентрации ренина в плазме крови. В другом исследовании комплекс сакубитрила и валсартана вызывал более выраженное снижение концентрации NT-proBNP в плазме крови и более значительное повышение концентраций мозгового натрийуретического пептида (BNP) и цГМФ в моче, чем эналаприл. В то время как BNP является субстратом неприлизина, NT-proBNP таковым не является, в связи с чем NT-proBNP, в отличие от BNP, можно использовать в качестве биомаркера при мониторинге пациентов с сердечной недостаточностью, получающих комплекс сакубитрила и валсартана.
В исследовании с подробным изучением интервала QTc у здоровых добровольцев мужского пола применение комплекса сакубитрила и валсартана однократно в дозах 400 мг и 1200 мг не оказывало влияния на реполяризацию миокарда.
Неприлизин — один из нескольких ферментов, участвующих в метаболизме амилоида-β (Aβ) головного мозга и спинномозговой жидкости (СМЖ). На фоне применения комплекса сакубитрила и валсартана в дозе 400 мг 1 раз в сутки в течение 2 недель у здоровых добровольцев концентрация Aβ 1-38 в СМЖ увеличивалась; при этом концентрации Aβ 1-40 и 1-42 в СМЖ не менялись. Клиническое значение этого факта неизвестно.
В клиническом исследовании применение комплекса сакубитрила и валсартана у пациентов с хронической сердечной недостаточностью статистически достоверно снижало риск летального исхода по причине сердечно-сосудистой патологии или госпитализации в связи с сердечной недостаточностью (21,8% в группе исследуемого препарата против 26,5% в группе эналаприла). Абсолютное снижение риска летального исхода по причине сердечно-сосудистой патологии или госпитализации в связи с сердечной недостаточностью составляло 4,7% (3,1% для риска летального исхода по причине сердечно-сосудистой патологии и 2,8% для первичной госпитализации в связи с сердечной недостаточностью).
Относительное снижение риска по сравнению с эналаприлом составляло 20%. Эффект отмечен на ранних этапах применения препарата и сохранялся на протяжении всего периода исследования. Развитию эффекта способствовали оба действующих компонента препарата. Частота случаев внезапной смерти, которые составляли 45% всех летальных исходов по причине сердечно-сосудистой патологии, в группе исследуемого препарата снизилась на 20% по сравнению с группой эналаприла (отношение рисков (hazard ratio, HR) 0,80, p=0,0082).
Частота случаев развития недостаточности сократительной функции миокарда, которая являлась причиной летального исхода в 26% случаев по причине сердечно-сосудистой патологии, в группе исследуемого препарата снизилась на 21% по сравнению с таковым показателем в группе эналаприла (HR 0,79, p=0,0338).
Фармакокинетика
Всасывание
После приема внутрь комплекс сакубитрила и валсартана распадается на сакубитрил, который затем метаболизируется с образованием метаболита – сакубитрилата, и валсартан; концентрации названных веществ в плазме крови достигают максимума через 0,5 ч, 2 ч и 1,5 ч соответственно. Абсолютная биодоступность сакубитрила и валсартана после приема внутрь составляет ≥60% и 23% соответственно. Валсартан в составе препарата Юперио обладает большей биодоступностью по сравнению с другими таблетированными формами.
В случае приема комплекса сакубитрила и валсартана дважды в сутки равновесные концентрации сакубитрила, сакубитрилата и валсартана достигаются через 3 дня. Статистически значимого накопления сакубитрила и валсартана в равновесном состоянии не отмечается; в то же время накопление сакубитрилата превышает концентрацию при однократном применении в 1,6 раза. Прием комплекса сакубитрила и валсартана одновременно с приемом пищи не оказывал клинически значимого влияния на показатели системного воздействия сакубитрила, сакубитрилата и валсартана. Снижение экспозиции валсартана в случае приема комплекса сакубитрила и валсартана одновременно с приемом пищи не сопровождается клинически значимым снижением терапевтического эффекта. Время приема комплекса сакубитрила и валсартана не зависит от времени приема пищи.
Распределение
Комплекс сакубитрила и валсартана в значительной степени связан с белками плазмы крови (94% – 97%). Сравнение экспозиций в плазме крови и СМЖ показывает, что сакубитрилат в небольшой степени проникает через гематоэнцефалический барьер (0,28%). Кажущийся объем распределения комплекса составляет от 75 до 103 л.
Метаболизм
Сакубитрил под действием ферментов быстро превращается в сакубитрилат, который далее существенно не метаболизируется. Валсартан метаболизируется в незначительной степени, в виде метаболитов обнаруживается лишь около 20% от введенной дозы. В плазме крови в незначительных концентрациях (<10%) обнаруживался гидроксильный метаболит. Поскольку и сакубитрил, и валсартан в минимальной степени метаболизируются при участии изоферментов цитохрома CYP450, изменение их фармакокинетики в случае одновременного применения препаратов, влияющих на изоферменты CYP450, представляется маловероятным.
Выведение
После приема внутрь 52–68% сакубитрила (главным образом, в виде сакубитрилата) и ~13% валсартана и его метаболитов выводятся почками; 37-48% сакубитрила (главным образом в виде сакубитрилата) и 86% валсартана и его метаболитов выводятся через кишечник.
Сакубитрил, сакубитрилат и валсартан выводятся из плазмы крови со средними периодами полувыведения (T1/2), составляющими приблизительно 1,43 ч, 11,48 ч и 9,90 ч соответственно.
Линейность / нелинейность
В изученном диапазоне доз комплекса сакубитрила и валсартана (50-400 мг) фармакокинетические параметры сакубитрила, сакубитрилата и валсартана изменяются пропорционально дозе.
Фармакокинетика в особых клинических случаях
Пациенты старше 65 лет
Экспозиции сакубитрилата и валсартана у пациентов данной категории выше на 42% и 30% соответственно, чем у пациентов более молодого возраста. Подобные различия не связаны с клинически значимыми эффектами, поэтому коррекции дозы препарата не требуется.
Пациенты моложе 18 лет
Применение препарата у пациентов данной категории не изучено.
Пациенты с нарушениями функции почек
Для сакубитрилата наблюдалась корреляция между функцией почек и площадью под кривой «концентрация-время» (AUC), для валсартана такой корреляции не наблюдалось. У пациентов с нарушениями функции почек легкой (расчётная скорость клубочковой фильтрации (рСКФ) 89-60 мл/мин/1,73 м2) и умеренной степени тяжести (59-30 мл/мин/1,73 м2).
AUC сакубитрилата была в 2 раза выше, чем у пациентов с нормальной функцией почек. У пациентов с нарушениями функции почек легкой и умеренной степени тяжести коррекции дозы препарата не требуется.
У пациентов с нарушениями функции почек тяжелой степени (рСКФ <30 мл/мин/1,73 м2) AUC сакубитрилата увеличивалась в 2,7 раза, у пациентов данной категории рекомендуемая начальная доза препарата составляет 50 мг 2 раза в сутки. Следует соблюдать осторожность при применении препарата у пациентов с нарушением функции почек тяжелой степени в связи с ограниченностью соответствующих данных.
Данных по применению препарата у пациентов, находящихся на гемодиализе, нет. Однако и сакубитрилат, и валсартан в значительной степени связываются с белками плазмы крови, поэтому их эффективное удаление из крови при гемодиализе маловероятно.
Пациенты с нарушениями функции печени
У пациентов с нарушениями функции печени легкой и умеренной степени тяжести экспозиция сакубитрила увеличивалась в 1,5 и 3,4 раза соответственно. Экспозиция сакубитрилата — в 1,5 и 1,9 раза, валсартана — в 1,2 и 2,1 раза (в сравнении со здоровыми добровольцами). У пациентов с нарушениями функции печени легкой степени тяжести (класс A по классификации Чайлд-Пью), включая пациентов с обструкцией желчных путей, коррекции дозы препарата не требуется.
У пациентов с нарушениями функции печени умеренной степени (класс B по классификации Чайлд-Пью) рекомендуемая начальная доза препарата составляет 50 мг 2 раза в сутки.
В связи с отсутствием данных применение у пациентов с нарушениями функции печени тяжелой степени не рекомендовано.
Этническая принадлежность
Фармакокинетика комплекса сакубитрила и валсартана (сакубитрил, сакубитрилат и валсартан) у пациентов разных расовых и этнических групп существенно не различается.
Пол
Фармакокинетика комплекса сакубитрила и валсартана (сакубитрил, сакубитрилат и валсартан) у мужчин и женщин существенно не различается.
Показания
Показания
Действующее вещество
Действующее вещество
Состав
Состав
1 ÑаблеÑка, покÑÑÑÐ°Ñ Ð¿Ð»ÐµÐ½Ð¾Ñной оболоÑкой, 100 мг (51,4 мг + 48,6 мг) ÑодеÑжиÑ:
ÐейÑÑвÑÑÑее веÑеÑÑво:
ÑакÑбиÑÑила и валÑаÑÑана гидÑаÑнÑй ÐºÐ¾Ð¼Ð¿Ð»ÐµÐºÑ Ð½Ð°ÑÑиевÑÑ Ñолей – 113,103 мг (в пеÑеÑÑеÑе на киÑлоÑнÑÑ ÑоÑÐ¼Ñ Ð±ÐµÐ·Ð²Ð¾Ð´Ð½ÑÑ 100 мг, ÑÑо ÑквиваленÑно ÑодеÑÐ¶Ð°Ð½Ð¸Ñ ÑакÑбиÑÑила 48,6 мг и валÑаÑÑана 51,4 мг);
ÐÑпомогаÑелÑнÑе веÑеÑÑва: ÑеллÑлоза микÑокÑиÑÑаллиÑеÑкаÑ, гипÑолоза, кÑоÑповидон, Ð¼Ð°Ð³Ð½Ð¸Ñ ÑÑеаÑаÑ, ÑалÑк, кÑÐµÐ¼Ð½Ð¸Ñ Ð´Ð¸Ð¾ÐºÑид коллоиднÑй; оболоÑка: пÑÐµÐ¼Ð¸ÐºÑ Ð¾Ð±Ð¾Ð»Ð¾Ñки белÑй (гипÑомеллоза, ÑиÑана диокÑид (E171), макÑогол 4000, ÑалÑк), пÑÐµÐ¼Ð¸ÐºÑ Ð¾Ð±Ð¾Ð»Ð¾Ñки желÑÑй (гипÑомеллоза, кÑаÑиÑÐµÐ»Ñ Ð¶ÐµÐ»ÐµÐ·Ð° окÑид желÑÑй (E172), макÑогол 4000, ÑалÑк), пÑÐµÐ¼Ð¸ÐºÑ Ð¾Ð±Ð¾Ð»Ð¾Ñки кÑаÑнÑй (гипÑомеллоза, кÑаÑиÑÐµÐ»Ñ Ð¶ÐµÐ»ÐµÐ·Ð° окÑид кÑаÑнÑй (E172), макÑогол 4000, ÑалÑк).
Как принимать, дозировка
Как принимать, дозировка
ÐÑÐµÐ¼Ñ Ð¿Ñиема пÑепаÑаÑа ЮпеÑио не завиÑÐ¸Ñ Ð¾Ñ Ð²Ñемени пÑиема пиÑи.
Ð¦ÐµÐ»ÐµÐ²Ð°Ñ (макÑималÑÐ½Ð°Ñ ÑÑÑоÑнаÑ) доза пÑепаÑаÑа ЮпеÑио ÑоÑÑавлÑÐµÑ 200 мг (102,8 мг + 97,2 мг) 2 Ñаза в ÑÑÑки. РекомендÑÐµÐ¼Ð°Ñ Ð½Ð°ÑалÑÐ½Ð°Ñ Ð´Ð¾Ð·Ð° пÑепаÑаÑа ЮпеÑио ÑоÑÑавлÑÐµÑ 100 мг (51,4 мг + 48,6 мг) 2 Ñаза в ÑÑÑки. РзавиÑимоÑÑи Ð¾Ñ Ð¿ÐµÑеноÑимоÑÑи Ð´Ð¾Ð·Ñ Ð¿ÑепаÑаÑа ЮпеÑио ÑледÑÐµÑ ÑвелиÑиваÑÑ Ð² 2 Ñаза каждÑе 2-4 недели вплоÑÑ Ð´Ð¾ доÑÑÐ¸Ð¶ÐµÐ½Ð¸Ñ Ñелевой (макÑималÑной ÑÑÑоÑной) Ð´Ð¾Ð·Ñ 200 мг (102,8 мг + 97,2 мг) 2 Ñаза в ÑÑÑки.
У паÑиенÑов, не полÑÑавÑÐ¸Ñ Ñанее ÑеÑÐ°Ð¿Ð¸Ñ Ð¸ÐÐФ или ÐÐ Ð II, или полÑÑавÑÐ¸Ñ ÑÑи пÑепаÑаÑÑ Ð² Ð½Ð¸Ð·ÐºÐ¸Ñ Ð´Ð¾Ð·Ð°Ñ , наÑинаÑÑ ÑеÑÐ°Ð¿Ð¸Ñ Ð¿ÑепаÑаÑом ЮпеÑио ÑледÑÐµÑ Ð² дозе 50 мг (25,7 мг + 24,3 мг) 2 Ñаза в ÑÑÑки Ñ Ð¼ÐµÐ´Ð»ÐµÐ½Ð½Ñм повÑÑением Ð´Ð¾Ð·Ñ (Ñдваивание ÑÑÑоÑной Ð´Ð¾Ð·Ñ 1 Ñаз в 3-4 недели).
ÐÑименение пÑепаÑаÑа ЮпеÑио возможно не Ñанее, Ñем ÑеÑез 36 ÑаÑов поÑле оÑÐ¼ÐµÐ½Ñ Ð¸ÐÐФ, Ñак как в ÑлÑÑае одновÑеменного пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð²Ð¾Ð·Ð¼Ð¾Ð¶Ð½Ð¾ ÑазвиÑие ангионевÑоÑиÑеÑкого оÑека.
Так как в ÑоÑÑав пÑепаÑаÑа ЮпеÑио Ð²Ñ Ð¾Ð´Ð¸Ñ ÐÐ Ð II валÑаÑÑан, его не ÑледÑÐµÑ Ð¿ÑименÑÑÑ Ð¾Ð´Ð½Ð¾Ð²Ñеменно Ñ Ð´ÑÑгим пÑепаÑаÑом, в ÑоÑÑав коÑоÑого Ð²Ñ Ð¾Ð´Ð¸Ñ ÐÐ Ð II.
ÐÑи ÑазвиÑии пÑизнаков наÑÑÑÐµÐ½Ð¸Ñ Ð¿ÐµÑеноÑимоÑÑи пÑепаÑаÑа ЮпеÑио (клиниÑеÑки вÑÑаженное Ñнижение ÐÐ, гипеÑкалиемиÑ, наÑÑÑение ÑÑнкÑии поÑек), ÑледÑÐµÑ ÑаÑÑмоÑÑеÑÑ Ð²Ð¾Ð¿ÑÐ¾Ñ Ð¾ вÑеменном Ñнижении Ð´Ð¾Ð·Ñ Ð¸Ð»Ð¸ коÑÑекÑии Ð´Ð¾Ð·Ñ Ð¾Ð´Ð½Ð¾Ð²Ñеменно пÑименÑемÑÑ Ð»ÐµÐºÐ°ÑÑÑвеннÑÑ Ð¿ÑепаÑаÑов.
ÐаÑиенÑÑ Ð¾ÑобÑÑ ÐºÐ°ÑегоÑий
ÐаÑиенÑÑ Ñ Ð½Ð°ÑÑÑением ÑÑнкÑии поÑек
У паÑиенÑов Ñ Ð½Ð°ÑÑÑениÑми ÑÑнкÑии поÑек легкой (ÑСÐФ 60-90 мл/мин/1,73 м2) или ÑмеÑенной ÑÑепени ÑÑжеÑÑи (ÑСÐФ 30-60 мл/мин/1,73 м2) коÑÑекÑии Ð´Ð¾Ð·Ñ Ð¿ÑепаÑаÑа не ÑÑебÑеÑÑÑ (Ñм. Ñаздел «ФаÑмакологиÑеÑкие ÑвойÑÑва»).
У паÑиенÑов Ñ ÑÑжелÑм наÑÑÑением ÑÑнкÑии поÑек (ÑСÐФ <30 мл/мин/1,73 м2) ÑекомендÑÐµÐ¼Ð°Ñ Ð½Ð°ÑалÑÐ½Ð°Ñ Ð´Ð¾Ð·Ð° пÑепаÑаÑа ÑоÑÑавлÑÐµÑ 50 мг 2 Ñаза в ÑÑÑки.
ÐÑи пÑименении пÑепаÑаÑа ЮпеÑио Ñ Ð¿Ð°ÑиенÑов данной каÑегоÑии ÑекомендÑеÑÑÑ ÑоблÑдаÑÑ Ð¾ÑÑоÑожноÑÑÑ Ð² ÑвÑзи Ñ Ð¾Ð³ÑаниÑенноÑÑÑÑ ÑооÑвеÑÑÑвÑÑÑÐ¸Ñ Ð´Ð°Ð½Ð½ÑÑ .
ÐаÑиенÑÑ Ñ Ð½Ð°ÑÑÑением ÑÑнкÑии пеÑени
У паÑиенÑов Ñ Ð½Ð°ÑÑÑениÑми ÑÑнкÑии пеÑени легкой ÑÑепени (клаÑÑ A по клаÑÑиÑикаÑии Чайлд-ÐÑÑ) коÑÑекÑии Ð´Ð¾Ð·Ñ Ð¿ÑепаÑаÑа ЮпеÑио не ÑÑебÑеÑÑÑ.
У паÑиенÑов Ñ Ð½Ð°ÑÑÑениÑми ÑÑнкÑии пеÑени ÑмеÑенной ÑÑепени (клаÑÑ B по клаÑÑиÑикаÑии Чайлд-ÐÑÑ) ÑекомендÑÐµÐ¼Ð°Ñ Ð½Ð°ÑалÑÐ½Ð°Ñ Ð´Ð¾Ð·Ð° пÑепаÑаÑа ÑоÑÑавлÑÐµÑ 50 мг 2 Ñаза в ÑÑÑки.
ÐÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио не Ñекомендован к пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ñ Ð¿Ð°ÑиенÑов Ñ ÑÑжелÑми наÑÑÑениÑми ÑÑнкÑии пеÑени (клаÑÑ C по клаÑÑиÑикаÑии Чайлд-ÐÑÑ).
ÐÑименение Ñ Ð´ÐµÑей и подÑоÑÑков в возÑаÑÑе до 18 леÑ
ÐаннÑÑ Ð¿Ð¾ безопаÑноÑÑи и ÑÑÑекÑивноÑÑи пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑа ЮпеÑио Ñ Ð´ÐµÑей и подÑоÑÑков неÑ.
ÐÑименение Ñ Ð¿Ð°ÑиенÑов ÑÑаÑÑе 65 леÑ
У паÑиенÑов ÑÑаÑÑе 65 Ð»ÐµÑ ÐºÐ¾ÑÑекÑии Ð´Ð¾Ð·Ñ Ð½Ðµ ÑÑебÑеÑÑÑ.
Взаимодействие
Взаимодействие
ÐÑоÑивопоказаннÑе лекаÑÑÑвеннÑе взаимодейÑÑвиÑ
ÐнгибиÑоÑÑ ÐÐФ
ÐÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио пÑоÑивопоказан к пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð¾Ð´Ð½Ð¾Ð²Ñеменно Ñ Ð¸ÐÐФ, поÑколÑÐºÑ Ð¸Ð½Ð³Ð¸Ð±Ð¸Ñование непÑилизина одновÑеменно Ñ Ð¿Ñименением иÐÐФ Ð¼Ð¾Ð¶ÐµÑ ÑвелиÑиваÑÑ ÑиÑк ÑазвиÑÐ¸Ñ Ð°Ð½Ð³Ð¸Ð¾Ð½ÐµÐ²ÑоÑиÑеÑкого оÑека. ÐÑименение пÑепаÑаÑа ЮпеÑио возможно не ÑанÑÑе, Ñем ÑеÑез 36 ÑаÑов поÑле оÑÐ¼ÐµÐ½Ñ Ð¸ÐÐФ. ÐÑименение иÐÐФ возможно не ÑанÑÑе, Ñем ÑеÑез 36 ÑаÑов поÑле поÑледнего пÑиема пÑепаÑаÑа ЮпеÑио.
ÐлиÑкиÑен
ÐÑоÑивопоказано одновÑеменное пÑименение пÑепаÑаÑа ЮпеÑио Ñ Ð°Ð»Ð¸ÑкиÑен-ÑодеÑжаÑими пÑепаÑаÑами Ñ Ð¿Ð°ÑиенÑов Ñ ÑÐ°Ñ Ð°ÑнÑм диабеÑом или Ñ Ð½Ð°ÑÑÑениÑми ÑÑнкÑии поÑек (ÑСÐФ <60 мл/мин/1,73 м2 и не Ñекомендовано Ñ Ð´ÑÑÐ³Ð¸Ñ Ð¿Ð°ÑиенÑов.
ÐеÑекомендÑемÑе лекаÑÑÑвеннÑе взаимодейÑÑвиÑ
ÐнÑагониÑÑÑ ÑеÑепÑоÑов ангиоÑензина
ÐоÑколÑÐºÑ Ð¾Ð´Ð½Ð¾ из дейÑÑвÑÑÑÐ¸Ñ Ð²ÐµÑеÑÑв пÑепаÑаÑа ÑвлÑеÑÑÑ ÐÐ Ð II, одновÑеменное пÑименение Ñ Ð´ÑÑгим пÑепаÑаÑом, ÑодеÑжаÑим ÐÐ Ð II, не ÑекомендÑеÑÑÑ.
ÐекаÑÑÑвеннÑе взаимодейÑÑвиÑ, коÑоÑÑе Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ð¾ ÑÑиÑÑваÑÑ
ÐнгибиÑоÑÑ ÐÐÐ-ÐоРÑедÑкÑÐ°Ð·Ñ (ÑÑаÑинÑ)
ÐаннÑе иÑÑледований показÑваÑÑ, ÑÑо ÑакÑбиÑÑил подавлÑÐµÑ Ð°ÐºÑивноÑÑÑ Ð¿ÐµÑеноÑÑиков OATP1B1 и OATP1B3. ÐÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио Ð¼Ð¾Ð¶ÐµÑ ÑвелиÑиваÑÑ ÑиÑÑемнÑÑ ÑкÑпозиÑÐ¸Ñ ÑÐ°ÐºÐ¸Ñ ÑÑбÑÑÑаÑов OATP1B1 и OATP1B3, как ÑÑаÑинÑ. У паÑиенÑов, полÑÑавÑÐ¸Ñ Ð¿ÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио одновÑеменно Ñ Ð°ÑоÑваÑÑаÑином, макÑималÑÐ½Ð°Ñ ÐºÐ¾Ð½ÑенÑÑаÑÐ¸Ñ Ð² плазме кÑови (Cmax) аÑоÑваÑÑаÑина и его меÑаболиÑов ÑвелиÑивалаÑÑ Ð´Ð¾ 2 Ñаз, а AUC â до 1,3 Ñаз. СледÑÐµÑ ÑоблÑдаÑÑ Ð¾ÑÑоÑожноÑÑÑ Ð¿Ñи одновÑеменном пÑименении ÑÑаÑинов Ñ Ð¿ÑепаÑаÑом ЮпеÑио. Ðе оÑмеÑено клиниÑеÑки знаÑимого лекаÑÑÑвенного взаимодейÑÑÐ²Ð¸Ñ Ð¿Ñи одновÑеменном пÑименении пÑепаÑаÑа ЮпеÑио Ñ ÑимваÑÑаÑином.
СилденаÑил
У паÑиенÑов Ñ Ð²ÑÑаженнÑм повÑÑением ÐÐ, полÑÑаÑÑÐ¸Ñ Ð¿ÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио (до доÑÑÐ¸Ð¶ÐµÐ½Ð¸Ñ ÑавновеÑной конÑенÑÑаÑии), однокÑаÑное пÑименение ÑилденаÑила ÑÑиливало анÑигипеÑÑензивное дейÑÑвие по ÑÑÐ°Ð²Ð½ÐµÐ½Ð¸Ñ Ñ Ð¿Ñименением пÑепаÑаÑа ЮпеÑио в моноÑеÑапии. Ðо ÑÑой пÑиÑине Ñ Ð¿Ð°ÑиенÑов, полÑÑаÑÑÐ¸Ñ Ð®Ð¿ÐµÑио, пÑименÑÑÑ ÑилденаÑил или дÑÑгой ингибиÑÐ¾Ñ ÑоÑÑодиÑÑÑеÑÐ°Ð·Ñ 5-го Ñипа ÑледÑÐµÑ Ñ Ð¾ÑÑоÑожноÑÑÑÑ.
ÐÑедполагаемÑе лекаÑÑÑвеннÑе взаимодейÑÑвиÑ, коÑоÑÑе Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ð¾ ÑÑиÑÑваÑÑ
Ðалий
ÐдновÑеменное пÑименение калийÑбеÑегаÑÑÐ¸Ñ Ð´Ð¸ÑÑеÑиков (напÑимеÑ, ÑÑиамÑеÑена и амилоÑида), анÑагониÑÑов минеÑалокоÑÑикоидов (напÑимеÑ, ÑпиÑонолакÑона и ÑплеÑенона), пÑепаÑаÑов ÐºÐ°Ð»Ð¸Ñ Ð¸Ð»Ð¸ калийÑодеÑжаÑÐ¸Ñ Ð·Ð°Ð¼ÐµÐ½Ð¸Ñелей поваÑенной Ñоли Ð¼Ð¾Ð¶ÐµÑ Ð²ÑзÑваÑÑ Ð¿Ð¾Ð²ÑÑение ÑодеÑÐ¶Ð°Ð½Ð¸Ñ ÐºÐ°Ð»Ð¸Ñ Ð¸ конÑенÑÑаÑии кÑеаÑинина в ÑÑвоÑоÑке кÑови. У паÑиенÑов, полÑÑаÑÑÐ¸Ñ Ð¿ÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио одновÑеменно Ñ ÑÑими пÑепаÑаÑами, ÑекомендÑеÑÑÑ ÑегÑлÑÑно конÑÑолиÑоваÑÑ ÑодеÑжание ÐºÐ°Ð»Ð¸Ñ Ð² ÑÑвоÑоÑке кÑови.
ÐеÑÑеÑоиднÑе пÑоÑивовоÑпалиÑелÑнÑе пÑепаÑаÑÑ (ÐÐÐÐ), вклÑÑÐ°Ñ Ð¸Ð·Ð±Ð¸ÑаÑелÑнÑе ингибиÑоÑÑ ÑиклоокÑигеназÑ-2 (ингибиÑоÑÑ Ð¦ÐÐ-2)
ÐÑименение пÑепаÑаÑа ЮпеÑио одновÑеменно Ñ ÐÐÐÐ Ñ Ð¿Ð°ÑиенÑов в возÑаÑÑе ÑÑаÑÑе 65 леÑ, Ñ Ð¿Ð°ÑиенÑов Ñ Ð³Ð¸Ð¿Ð¾Ð²Ð¾Ð»ÐµÐ¼Ð¸ÐµÐ¹ (вклÑÑÐ°Ñ Ð¿Ð°ÑиенÑов, полÑÑаÑÑÐ¸Ñ Ð´Ð¸ÑÑеÑики) и Ñ Ð¿Ð°ÑиенÑов Ñ Ð½Ð°ÑÑÑениÑми ÑÑнкÑии поÑек Ð¼Ð¾Ð¶ÐµÑ ÑвелиÑиваÑÑ ÑиÑк ÑÑ ÑдÑÐµÐ½Ð¸Ñ ÑÑнкÑии поÑек. У паÑиенÑов, полÑÑаÑÑÐ¸Ñ Ð¿ÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио одновÑеменно Ñ ÐÐÐÐ, пÑи пÑименении подобной ÑÑ ÐµÐ¼Ñ Ð»ÐµÑÐµÐ½Ð¸Ñ Ð¸ в ÑлÑÑае ее Ð¸Ð·Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ ÑекомендÑеÑÑÑ ÐºÐ¾Ð½ÑÑолиÑоваÑÑ ÑÑнкÑÐ¸Ñ Ð¿Ð¾Ñек.
ÐÑепаÑаÑÑ Ð»Ð¸ÑиÑ
ÐозможноÑÑÑ Ð»ÐµÐºÐ°ÑÑÑвенного взаимодейÑÑÐ²Ð¸Ñ Ð¼ÐµÐ¶Ð´Ñ Ð¿ÑепаÑаÑом ЮпеÑио и пÑепаÑаÑами лиÑÐ¸Ñ Ð½Ðµ изÑÑали. ÐÑи одновÑеменном пÑименении пÑепаÑаÑов лиÑÐ¸Ñ Ñ Ð¸ÐÐФ и ÐÐ Ð II оÑмеÑалоÑÑ Ð¾Ð±ÑаÑимое повÑÑение ÑодеÑжание лиÑÐ¸Ñ Ð² ÑÑвоÑоÑке кÑови и ÑÑиление, в ÑвÑзи Ñ ÑÑим, ÑокÑиÑеÑÐºÐ¸Ñ Ð¿ÑоÑвлений.
У паÑиенÑов, полÑÑаÑÑÐ¸Ñ Ð¿ÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио вмеÑÑе Ñ Ð¿ÑепаÑаÑами лиÑиÑ, ÑекомендÑеÑÑÑ ÑÑаÑелÑно конÑÑолиÑоваÑÑ ÑодеÑжание лиÑÐ¸Ñ Ð² ÑÑвоÑоÑке кÑови. Ð ÑлÑÑае дополниÑелÑного пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð´Ð¸ÑÑеÑиÑеÑкого лекаÑÑÑвенного пÑепаÑаÑа ÑиÑк ÑокÑиÑеÑкого дейÑÑÐ²Ð¸Ñ Ð»Ð¸ÑÐ¸Ñ Ð¼Ð¾Ð¶ÐµÑ ÑвелиÑиваÑÑÑÑ.
Ðелки-пеÑеноÑÑики
ÐкÑивнÑй меÑÐ°Ð±Ð¾Ð»Ð¸Ñ ÑакÑбиÑÑила (ÑакÑбиÑÑилаÑ) и валÑаÑÑан ÑвлÑÑÑÑÑ ÑÑбÑÑÑаÑами белков-пеÑеноÑÑиков OATP1B1, OATP1B3 и OAT3; валÑаÑÑан Ñакже ÑвлÑеÑÑÑ ÑÑбÑÑÑаÑом белка-пеÑеноÑÑика MRP2. У паÑиенÑов, полÑÑаÑÑÐ¸Ñ Ð¿ÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио одновÑеменно Ñ Ð¸Ð½Ð³Ð¸Ð±Ð¸ÑоÑами OATP1B1, OATP1B3, OAT3 (напÑимеÑ, ÑиÑампиÑином и ÑиклоÑпоÑином) или MPR2 (напÑимеÑ, ÑиÑонавиÑом) Ð¼Ð¾Ð¶ÐµÑ ÑвелиÑиваÑÑÑÑ ÑиÑÑÐµÐ¼Ð½Ð°Ñ ÑкÑпозиÑÐ¸Ñ ÑакÑбиÑÑилаÑа или валÑаÑÑана ÑооÑвеÑÑÑвенно. РнаÑале и пÑи завеÑÑении одновÑеменного пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑа ЮпеÑио и данной гÑÑÐ¿Ð¿Ñ Ð¿ÑепаÑаÑов ÑÑебÑеÑÑÑ ÑоблÑдаÑÑ Ð¾ÑÑоÑожноÑÑÑ.
ÐÑÑÑÑÑÑвие знаÑимÑÑ Ð»ÐµÐºÐ°ÑÑÑвеннÑÑ Ð²Ð·Ð°Ð¸Ð¼Ð¾Ð´ÐµÐ¹ÑÑвий
Ð ÑлÑÑае пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑа ЮпеÑио в комбинаÑии Ñ ÑÑÑоÑемидом, дигокÑином, ваÑÑаÑином, гидÑÐ¾Ñ Ð»Ð¾ÑоÑиазидом, амлодипином, меÑÑоÑмином, омепÑазолом, каÑведилолом, ниÑÑоглиÑеÑином внÑÑÑивенно (в/в) или комбиниÑованнÑм пÑепаÑаÑом левоноÑгеÑÑÑела и ÑÑинилÑÑÑÑадиола клиниÑеÑки знаÑимÑÑ Ð²Ð·Ð°Ð¸Ð¼Ð¾Ð´ÐµÐ¹ÑÑвий вÑÑвлено не бÑло. ÐзаимодейÑÑвий Ñ Ð°Ñенололом, индомеÑаÑином, глибенкламидом (глибÑÑидом) или ÑимеÑидином пÑи одновÑеменном пÑименении Ñ Ð¿ÑепаÑаÑом ЮпеÑио не ожидаеÑÑÑ.
ÐзаимодейÑÑÐ²Ð¸Ñ Ñ Ð¸Ð·Ð¾ÑеÑменÑами ÑиÑÑÐµÐ¼Ñ ÑиÑÐ¾Ñ Ñома P450
ÐмеÑÑиеÑÑ Ð¸ÑÑÐ»ÐµÐ´Ð¾Ð²Ð°Ð½Ð¸Ñ Ð´ÐµÐ¼Ð¾Ð½ÑÑÑиÑÑÑÑ, ÑÑо веÑоÑÑноÑÑÑ Ð»ÐµÐºÐ°ÑÑÑвеннÑÑ Ð²Ð·Ð°Ð¸Ð¼Ð¾Ð´ÐµÐ¹ÑÑвий, опоÑÑедованнÑÑ Ð¸Ð·Ð¾ÑеÑменÑами ÑиÑÐ¾Ñ Ñома CYP450, невелика, Ñак как ÐºÐ¾Ð¼Ð¿Ð»ÐµÐºÑ Ð´ÐµÐ¹ÑÑвÑÑÑÐ¸Ñ Ð²ÐµÑеÑÑв в незнаÑиÑелÑной ÑÑепени меÑаболизиÑÑеÑÑÑ Ð¿Ñи ÑÑаÑÑии изоÑеÑменÑов CYP450. ÐÐ¾Ð¼Ð¿Ð»ÐµÐºÑ Ð´ÐµÐ¹ÑÑвÑÑÑÐ¸Ñ Ð²ÐµÑеÑÑв пÑепаÑаÑа ЮпеÑио не ÑвлÑеÑÑÑ Ð¸Ð½Ð³Ð¸Ð±Ð¸ÑоÑом или индÑкÑоÑом изоÑеÑменÑов CYP450.
Специальные указания
Специальные указания
ÐÑÑаженное Ñнижение ÐÐ
У паÑиенÑов, полÑÑавÑÐ¸Ñ Ð¿ÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио, оÑмеÑалиÑÑ ÑлÑÑаи клиниÑеÑки вÑÑаженной аÑÑеÑиалÑной гипоÑензии. ÐÑи возникновении аÑÑеÑиалÑной гипоÑензии ÑледÑÐµÑ ÑаÑÑмоÑÑеÑÑ Ð²Ð¾Ð¿ÑÐ¾Ñ Ð¾ коÑÑекÑии Ð´Ð¾Ð·Ñ Ð´Ð¸ÑÑеÑиков, ÑопÑÑÑÑвÑÑÑÐ¸Ñ Ð³Ð¸Ð¿Ð¾ÑензивнÑÑ ÑÑедÑÑв, а Ñакже об ÑÑÑÑанении пÑиÑин Ð²Ð¾Ð·Ð½Ð¸ÐºÐ½Ð¾Ð²ÐµÐ½Ð¸Ñ Ð°ÑÑеÑиалÑной гипоÑензии (напÑимеÑ, гиповолемии). ÐÑли, неÑмоÑÑÑ Ð½Ð° ÑÑи меÑÑ, аÑÑеÑиалÑÐ½Ð°Ñ Ð³Ð¸Ð¿Ð¾ÑÐµÐ½Ð·Ð¸Ñ ÑÐ¾Ñ ÑанÑеÑÑÑ, Ð´Ð¾Ð·Ñ Ð¿ÑепаÑаÑа ЮпеÑио ÑледÑÐµÑ ÑменÑÑиÑÑ Ð¸Ð»Ð¸ пÑепаÑÐ°Ñ ÑледÑÐµÑ Ð½Ð° вÑÐµÐ¼Ñ Ð¾ÑмениÑÑ. ÐконÑаÑелÑÐ½Ð°Ñ Ð¾Ñмена пÑепаÑаÑа обÑÑно не ÑÑебÑеÑÑÑ. ÐеÑоÑÑноÑÑÑ Ð²Ð¾Ð·Ð½Ð¸ÐºÐ½Ð¾Ð²ÐµÐ½Ð¸Ñ Ð°ÑÑеÑиалÑной гипоÑензии, как пÑавило, вÑÑе Ñ Ð¿Ð°ÑиенÑов Ñ Ð³Ð¸Ð¿Ð¾Ð²Ð¾Ð»ÐµÐ¼Ð¸ÐµÐ¹, коÑоÑÐ°Ñ Ð¼Ð¾Ð¶ÐµÑ Ð±ÑÑÑ Ð²Ñзвана ÑеÑапией диÑÑеÑиками, низкоÑолевой диеÑой, диаÑеей или ÑвоÑой. ÐеÑед наÑалом пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑа ЮпеÑио ÑледÑÐµÑ Ð¿ÑовеÑÑи коÑÑекÑÐ¸Ñ ÑодеÑÐ¶Ð°Ð½Ð¸Ñ Ð½Ð°ÑÑÐ¸Ñ Ð² оÑганизме и/или воÑполниÑÑ ÐЦÐ.
ÐаÑÑÑÐµÐ½Ð¸Ñ ÑÑнкÑии поÑек
Ðак и лÑбой дÑÑгой пÑепаÑаÑ, дейÑÑвÑÑÑий на Ð ÐÐС, пÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио Ð¼Ð¾Ð¶ÐµÑ Ð²ÑзÑваÑÑ ÑÑ ÑдÑение ÑÑнкÑии поÑек. Ð ÑÑавниÑелÑном иÑÑледовании безопаÑноÑÑи и ÑÑÑекÑивноÑÑи (по ÑÑÐ°Ð²Ð½ÐµÐ½Ð¸Ñ Ñ ÑналапÑилом) клиниÑеÑки знаÑимÑе наÑÑÑÐµÐ½Ð¸Ñ ÑÑнкÑии поÑек оÑмеÑалиÑÑ Ñедко, а пÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио в ÑвÑзи Ñ Ð¿Ð¾Ð´Ð¾Ð±Ð½Ñми наÑÑÑениÑми оÑменÑли Ñеже (0,65%), Ñем ÑналапÑил (1,28%). Ð ÑлÑÑае клиниÑеÑки знаÑимого ÑÑ ÑдÑÐµÐ½Ð¸Ñ ÑÑнкÑии поÑек ÑледÑÐµÑ ÑаÑÑмоÑÑеÑÑ Ð²Ð¾Ð¿ÑÐ¾Ñ Ð¾Ð± ÑменÑÑении Ð´Ð¾Ð·Ñ Ð¿ÑепаÑаÑа ЮпеÑио. ÐÑи пÑименении пÑепаÑаÑа ЮпеÑио Ñ Ð¿Ð°ÑиенÑов Ñ ÑÑжелÑми наÑÑÑениÑми ÑÑнкÑии поÑек ÑледÑÐµÑ ÑоблÑдаÑÑ Ð¾ÑÑоÑожноÑÑÑ.
ÐипеÑкалиемиÑ
Ðак и лÑбой дÑÑгой пÑепаÑаÑ, дейÑÑвÑÑÑий на Ð ÐÐС, пÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио Ð¼Ð¾Ð¶ÐµÑ ÑвелиÑиваÑÑ ÑиÑк ÑазвиÑÐ¸Ñ Ð³Ð¸Ð¿ÐµÑкалиемии. Ð ÑÑавниÑелÑном иÑÑледовании безопаÑноÑÑи и ÑÑÑекÑивноÑÑи (по ÑÑÐ°Ð²Ð½ÐµÐ½Ð¸Ñ Ñ ÑналапÑилом) клиниÑеÑки знаÑÐ¸Ð¼Ð°Ñ Ð³Ð¸Ð¿ÐµÑÐºÐ°Ð»Ð¸ÐµÐ¼Ð¸Ñ Ð¾ÑмеÑалаÑÑ Ñедко; пÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио в ÑвÑзи Ñ Ð³Ð¸Ð¿ÐµÑкалиемией бÑл оÑменен Ñ 0,26% паÑиенÑов, а ÑналапÑил â Ñ 0,35% паÑиенÑов. ÐÑепаÑаÑÑ, ÑпоÑобнÑе ÑвелиÑиваÑÑ ÑодеÑжание ÐºÐ°Ð»Ð¸Ñ Ð² ÑÑвоÑоÑке кÑови (напÑимеÑ, калийÑбеÑегаÑÑие диÑÑеÑики, пÑепаÑаÑÑ ÐºÐ°Ð»Ð¸Ñ), одновÑеменно Ñ Ð¿ÑепаÑаÑом ЮпеÑио ÑледÑÐµÑ Ð¿ÑименÑÑÑ Ñ Ð¾ÑÑоÑожноÑÑÑÑ. Ð ÑлÑÑае Ð²Ð¾Ð·Ð½Ð¸ÐºÐ½Ð¾Ð²ÐµÐ½Ð¸Ñ ÐºÐ»Ð¸Ð½Ð¸ÑеÑки знаÑимой гипеÑкалиемии ÑледÑÐµÑ ÑаÑÑмоÑÑеÑÑ Ñакие меÑÑ, как Ñнижение поÑÑÐµÐ±Ð»ÐµÐ½Ð¸Ñ ÐºÐ°Ð»Ð¸Ñ Ñ Ð¿Ð¸Ñей или коÑÑекÑÐ¸Ñ Ð´Ð¾Ð·Ñ ÑопÑÑÑÑвÑÑÑÐ¸Ñ Ð¿ÑепаÑаÑов. РекомендÑеÑÑÑ ÑегÑлÑÑно конÑÑолиÑоваÑÑ ÑодеÑжание ÐºÐ°Ð»Ð¸Ñ Ð² ÑÑвоÑоÑке кÑови, в оÑобенноÑÑи Ñ Ð¿Ð°ÑиенÑов Ñ Ñакими ÑакÑоÑами ÑиÑка, как ÑÑжелÑе наÑÑÑÐµÐ½Ð¸Ñ ÑÑнкÑии поÑек, ÑÐ°Ñ Ð°ÑнÑй диабеÑ, гипоалÑдоÑÑеÑонизм или диеÑа Ñ Ð²ÑÑоким ÑодеÑжанием калиÑ.
ÐнгионевÑоÑиÑеÑкий оÑек
Ðа Ñоне пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑа ЮпеÑио оÑмеÑалиÑÑ ÑлÑÑаи ÑазвиÑÐ¸Ñ Ð°Ð½Ð³Ð¸Ð¾Ð½ÐµÐ²ÑоÑиÑеÑкого оÑека. ÐÑи возникновении ангионевÑоÑиÑеÑкого оÑека пÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио ÑледÑÐµÑ Ð½ÐµÐ¼ÐµÐ´Ð»ÐµÐ½Ð½Ð¾ оÑмениÑÑ Ð¸ наÑаÑÑ Ð½Ð°Ð´Ð»ÐµÐ¶Ð°Ñее леÑение Ñ Ð½Ð°Ð±Ð»Ñдением паÑиенÑа до полного и ÑÑойкого ÑазÑеÑÐµÐ½Ð¸Ñ Ð²ÑÐµÑ Ð²Ð¾Ð·Ð½Ð¸ÐºÑÐ¸Ñ ÑимпÑомов. ÐовÑоÑно назнаÑаÑÑ Ð¿ÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио не ÑледÑеÑ. Ð ÑлÑÑаÑÑ Ð¿Ð¾Ð´ÑвеÑжденного ангионевÑоÑиÑеÑкого оÑека, пÑи коÑоÑом оÑек ÑаÑпÑоÑÑÑанÑлÑÑ ÑолÑко на лиÑо и гÑбÑ, данное ÑоÑÑоÑние, как пÑавило, ÑазÑеÑалоÑÑ Ð±ÐµÐ· вмеÑаÑелÑÑÑва, Ñ Ð¾ÑÑ Ð¿Ñименение анÑигиÑÑаминнÑÑ ÑÑедÑÑв ÑпоÑобÑÑвовало облегÑÐµÐ½Ð¸Ñ ÑимпÑомов.
ÐнгионевÑоÑиÑеÑкий оÑек, ÑопÑовождаÑÑийÑÑ Ð¾Ñеком гоÑÑани, Ð¼Ð¾Ð¶ÐµÑ Ð¿ÑивеÑÑи к леÑалÑÐ½Ð¾Ð¼Ñ Ð¸ÑÑ Ð¾Ð´Ñ. Ð ÑÐµÑ ÑлÑÑаÑÑ , когда оÑек ÑаÑпÑоÑÑÑанÑеÑÑÑ Ð½Ð° ÑзÑк, голоÑовÑе Ñкладки или гоÑÑанÑ, ÑÑо Ð¼Ð¾Ð¶ÐµÑ Ð¿ÑивеÑÑи к обÑÑÑÑкÑии дÑÑ Ð°ÑелÑнÑÑ Ð¿ÑÑей, Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ð¾ немедленно наÑаÑÑ Ð½Ð°Ð´Ð»ÐµÐ¶Ð°Ñее леÑение, напÑимеÑ, подкожное введение ÑаÑÑвоÑа ÑпинеÑÑина (адÑеналина) 1:1000 (0,3-0,5 мл), и/или пÑинÑÑÑ Ð½Ð°Ð´Ð»ÐµÐ¶Ð°Ñие меÑÑ Ð¿Ð¾ обеÑпеÑÐµÐ½Ð¸Ñ Ð¿ÑÐ¾Ñ Ð¾Ð´Ð¸Ð¼Ð¾ÑÑи дÑÑ Ð°ÑелÑнÑÑ Ð¿ÑÑей.
У паÑиенÑов Ñ Ð°Ð½Ð³Ð¸Ð¾Ð½ÐµÐ²ÑоÑиÑеÑким оÑеком на Ñоне пÑедÑеÑÑвÑÑÑей ÑеÑапии иÐÐФ или ÐÐ Ð II в анамнезе, а Ñакже Ñ Ð¿Ð°ÑиенÑов Ñ Ð½Ð°ÑледÑÑвеннÑм ангионевÑоÑиÑеÑким оÑеком пÑименение пÑепаÑаÑа пÑоÑивопоказано
ÐаÑиенÑÑ Ð½ÐµÐ³Ñоидной ÑаÑÑ Ð¼Ð¾Ð³ÑÑ Ð±ÑÑÑ Ð±Ð¾Ð»ÐµÐµ подвеÑÐ¶ÐµÐ½Ñ ÑиÑÐºÑ Ð°Ð½Ð³Ð¸Ð¾Ð½ÐµÐ²ÑоÑиÑеÑкого оÑека.
ÐаÑиенÑÑ Ñо ÑÑенозом поÑеÑной аÑÑеÑии
Ðак и дÑÑгие пÑепаÑаÑÑ, дейÑÑвÑÑÑие на Ð ÐÐС, пÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио Ð¼Ð¾Ð¶ÐµÑ Ð²ÑзÑваÑÑ Ð¿Ð¾Ð²ÑÑение конÑенÑÑаÑии моÑÐµÐ²Ð¸Ð½Ñ Ð¸ кÑеаÑинина в ÑÑвоÑоÑке кÑови Ñ Ð¿Ð°ÑиенÑов Ñ Ð¾Ð´Ð½Ð¾ÑÑоÑонним или двÑÑÑоÑонним ÑÑенозом поÑеÑнÑÑ Ð°ÑÑеÑий. У паÑиенÑов Ñо ÑÑенозом поÑеÑной аÑÑеÑии пÑепаÑÐ°Ñ ÑледÑÐµÑ Ð¿ÑименÑÑÑ Ñ Ð¾ÑÑоÑожноÑÑÑÑ, ÑегÑлÑÑно конÑÑолиÑÑÑ ÑÑнкÑÐ¸Ñ Ð¿Ð¾Ñек.
ÐлиÑние на ÑпоÑобноÑÑÑ ÑпÑавлÑÑÑ ÑÑанÑпоÑÑнÑми ÑÑедÑÑвами и/или Ð¼ÐµÑ Ð°Ð½Ð¸Ð·Ð¼Ð°Ð¼Ð¸
ÐÑÑÑÑÑÑвÑÑÑ Ð´Ð°Ð½Ð½Ñе о влиÑнии пÑепаÑаÑа на ÑпоÑобноÑÑÑ ÑпÑавлÑÑÑ ÑÑанÑпоÑÑнÑми ÑÑедÑÑвами и/или Ð¼ÐµÑ Ð°Ð½Ð¸Ð·Ð¼Ð°Ð¼Ð¸. Ð ÑвÑзи Ñ Ð²Ð¾Ð·Ð¼Ð¾Ð¶Ð½Ñм возникновением головокÑÑÐ¶ÐµÐ½Ð¸Ñ Ð¸Ð»Ð¸ повÑÑенной ÑÑомлÑемоÑÑи ÑледÑÐµÑ ÑоблÑдаÑÑ Ð¾ÑÑоÑожноÑÑÑ Ð¿Ñи вождении авÑоÑÑанÑпоÑÑа или ÑабоÑе Ñ Ð¼ÐµÑ Ð°Ð½Ð¸Ð·Ð¼Ð°Ð¼Ð¸.
Краткое описание
Краткое описание
Противопоказания
Противопоказания
С оÑÑоÑожноÑÑÑÑ
Побочные действия
Побочные действия
РиÑÑледовании безопаÑноÑÑи пÑодолжиÑелÑноÑÑÑ ÑеÑапии пÑепаÑаÑом Ñ Ð¿Ð°ÑиенÑов Ñ Ñ ÑониÑеÑкой ÑеÑдеÑной недоÑÑаÑоÑноÑÑÑÑ ÑоÑÑавлÑла до 4,3 леÑ, ÑÑеднÑÑ Ð¿ÑодолжиÑелÑноÑÑÑ Ð¿Ñиема ÑоÑÑавила 24 меÑÑÑа.
ÐÑекÑаÑение ÑеÑапии в ÑвÑзи Ñ ÑазвиÑием нежелаÑелÑнÑÑ Ñвлений (ÐЯ) поÑÑебовалоÑÑ Ñ 10,71% паÑиенÑов, полÑÑавÑÐ¸Ñ Ð¿ÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио, и Ñ 12,20%, полÑÑавÑÐ¸Ñ Ð¿ÑепаÑÐ°Ñ ÑÑавнениÑ. ЯвлениÑ, наиболее ÑаÑÑо ÑвÑзаннÑе Ñ ÐºÐ¾ÑÑекÑией Ð´Ð¾Ð·Ñ Ð¿ÑепаÑаÑа или пÑекÑаÑением ÑеÑапии, бÑли: аÑÑеÑиалÑÐ½Ð°Ñ Ð³Ð¸Ð¿Ð¾ÑензиÑ, гипеÑÐºÐ°Ð»Ð¸ÐµÐ¼Ð¸Ñ Ð¸ наÑÑÑение ÑÑнкÑии поÑек. ÐÑÑвленнÑе нежелаÑелÑнÑе лекаÑÑÑвеннÑе ÑеакÑии (ÐÐÐ ) ÑооÑвеÑÑÑвовали ÑаÑмакологиÑеÑким Ñ Ð°ÑакÑеÑиÑÑикам пÑепаÑаÑа ЮпеÑио и ÑопÑÑÑÑвÑÑÑим заболеваниÑм, имеÑÑимÑÑ Ñ Ð¿Ð°ÑиенÑов.
ЧаÑÑоÑа нежелаÑелÑнÑÑ ÑеакÑий (ÐÐ ) не завиÑела Ð¾Ñ Ð¿Ð¾Ð»Ð°, возÑаÑÑа или ÑаÑовой пÑинадлежноÑÑи.
ÐÐРпеÑеÑиÑÐ»ÐµÐ½Ñ Ð² ÑооÑвеÑÑÑвии Ñ ÑиÑÑемно-оÑганнÑм клаÑÑом медиÑинÑкого ÑловаÑÑ Ð´Ð»Ñ Ð½Ð¾ÑмаÑивно-пÑавовой деÑÑелÑноÑÑи MedDRA. РпÑÐµÐ´ÐµÐ»Ð°Ñ ÐºÐ°Ð¶Ð´Ð¾Ð³Ð¾ ÑиÑÑемно-оÑганного клаÑÑа ÐÐÐ ÑаÑпÑÐµÐ´ÐµÐ»ÐµÐ½Ñ Ð¿Ð¾ ÑаÑÑоÑе Ð²Ð¾Ð·Ð½Ð¸ÐºÐ½Ð¾Ð²ÐµÐ½Ð¸Ñ Ð² поÑÑдке ÑменÑÑÐµÐ½Ð¸Ñ Ð¸Ñ Ð·Ð½Ð°ÑимоÑÑи. ÐÐ»Ñ Ð¾Ñенки ÑаÑÑоÑÑ Ð¸ÑполÑÐ·Ð¾Ð²Ð°Ð½Ñ ÑледÑÑÑие кÑиÑеÑии: оÑÐµÐ½Ñ ÑаÑÑо (â¥1/10); ÑаÑÑо (Ð¾Ñ â¥1/100 до <1/10); неÑаÑÑо (Ð¾Ñ â¥1/1000 до <1/100); Ñедко (Ð¾Ñ â¥1/10000 до <1/1000); оÑÐµÐ½Ñ Ñедко (<1/10000), вклÑÑÐ°Ñ Ð¾ÑделÑнÑе ÑообÑениÑ; ÑаÑÑоÑа неизвеÑÑна – поÑколÑÐºÑ Ð¸Ð½ÑоÑмаÑÐ¸Ñ Ð¾ даннÑÑ ÐÐРполÑÑена в поÑÑÑегиÑÑÑаÑионном пеÑиоде из ÑпонÑаннÑÑ ÑообÑений и ÑообÑений в лиÑеÑаÑÑÑе, ÑоÑно оÑениÑÑ ÑаÑÑоÑÑ Ð²ÑÑÑеÑаемоÑÑи и пÑиÑинно-ÑледÑÑвеннÑÑ ÑвÑÐ·Ñ Ñ Ð¿ÑепаÑаÑом не вÑегда пÑедÑÑавлÑеÑÑÑ Ð²Ð¾Ð·Ð¼Ð¾Ð¶Ð½Ñм, Ð´Ð»Ñ Ð´Ð°Ð½Ð½ÑÑ ÑеакÑий Ñказано «ÑаÑÑоÑа неизвеÑÑна»).
ÐаÑÑÑÐµÐ½Ð¸Ñ Ñо ÑÑоÑÐ¾Ð½Ñ Ð¸Ð¼Ð¼Ñнной ÑиÑÑемÑ: ÑаÑÑоÑа неизвеÑÑна – гипеÑÑÑвÑÑвиÑелÑноÑÑÑ (вклÑÑÐ°Ñ ÐºÐ¾Ð¶Ð½ÑÑ ÑÑпÑ, кожнÑй зÑд, анаÑилакÑиÑ).
ÐаÑÑÑÐµÐ½Ð¸Ñ Ñо ÑÑоÑÐ¾Ð½Ñ Ð¾Ð±Ð¼ÐµÐ½Ð° веÑеÑÑв и пиÑаниÑ: оÑÐµÐ½Ñ ÑаÑÑо â гипеÑкалиемиÑ; ÑаÑÑо â гипокалиемиÑ.
ÐаÑÑÑÐµÐ½Ð¸Ñ Ñо ÑÑоÑÐ¾Ð½Ñ Ð½ÐµÑвной ÑиÑÑемÑ: ÑаÑÑо – головокÑÑжение, Ð³Ð¾Ð»Ð¾Ð²Ð½Ð°Ñ Ð±Ð¾Ð»Ñ; неÑаÑÑо â оÑÑоÑÑаÑиÑеÑкое головокÑÑжение.
ÐаÑÑÑÐµÐ½Ð¸Ñ Ñо ÑÑоÑÐ¾Ð½Ñ Ð¾Ñгана ÑлÑÑ Ð° и лабиÑинÑнÑе наÑÑÑениÑ: ÑаÑÑо â веÑÑиго.
ÐаÑÑÑÐµÐ½Ð¸Ñ Ñо ÑÑоÑÐ¾Ð½Ñ ÑоÑÑдов: оÑÐµÐ½Ñ ÑаÑÑо â аÑÑеÑиалÑÐ½Ð°Ñ Ð³Ð¸Ð¿Ð¾ÑензиÑ; ÑаÑÑо â обмоÑок, оÑÑоÑÑаÑиÑеÑÐºÐ°Ñ Ð³Ð¸Ð¿Ð¾ÑензиÑ.
ÐаÑÑÑÐµÐ½Ð¸Ñ Ñо ÑÑоÑÐ¾Ð½Ñ Ð´ÑÑ Ð°ÑелÑной ÑиÑÑемÑ, оÑганов гÑÑдной клеÑки и ÑÑедоÑÑениÑ: ÑаÑÑо â каÑелÑ.
ÐаÑÑÑÐµÐ½Ð¸Ñ Ñо ÑÑоÑÐ¾Ð½Ñ Ð¶ÐµÐ»ÑдоÑно-киÑеÑного ÑÑакÑа: ÑаÑÑо â диаÑеÑ, ÑоÑноÑа.
ÐаÑÑÑÐµÐ½Ð¸Ñ Ñо ÑÑоÑÐ¾Ð½Ñ ÐºÐ¾Ð¶Ð¸ и подкожнÑÑ Ñканей: неÑаÑÑо â ангионевÑоÑиÑеÑкий оÑек.
ÐаÑÑÑÐµÐ½Ð¸Ñ Ñо ÑÑоÑÐ¾Ð½Ñ Ð¿Ð¾Ñек и моÑевÑводÑÑÐ¸Ñ Ð¿ÑÑей: оÑÐµÐ½Ñ ÑаÑÑо â наÑÑÑение ÑÑнкÑии поÑек; ÑаÑÑо â поÑеÑÐ½Ð°Ñ Ð½ÐµÐ´Ð¾ÑÑаÑоÑноÑÑÑ (в Ñ.Ñ. оÑÑÑÐ°Ñ Ð¿Ð¾ÑеÑÐ½Ð°Ñ Ð½ÐµÐ´Ð¾ÑÑаÑоÑноÑÑÑ).
ÐбÑие ÑаÑÑÑÑойÑÑва и наÑÑÑÐµÐ½Ð¸Ñ Ð² меÑÑе введениÑ: ÑаÑÑо â повÑÑÐµÐ½Ð½Ð°Ñ ÑÑомлÑемоÑÑÑ, аÑÑениÑ.
ÐÑли лÑбÑе из ÑказаннÑÑ Ð² инÑÑÑÑкÑии побоÑнÑÑ ÑÑÑекÑов ÑÑÑгÑблÑÑÑÑÑ, или ÐÑ Ð·Ð°Ð¼ÐµÑили лÑбÑе дÑÑгие побоÑнÑе ÑÑÑекÑÑ, не ÑказаннÑе в инÑÑÑÑкÑии, ÑообÑиÑе об ÑÑом вÑаÑÑ.
Передозировка
Передозировка
ÐаннÑÑ Ð¾ пеÑедозиÑовке пÑепаÑаÑом ЮпеÑио Ñ Ñеловека недоÑÑаÑоÑно. ÐднокÑаÑное пÑименение пÑепаÑаÑа в дозе 1200 мг и многокÑаÑное в дозе 900 мг Ñ Ð·Ð´Ð¾ÑовÑÑ Ð´Ð¾Ð±ÑоволÑÑев ÑопÑовождалоÑÑ Ñ Ð¾ÑоÑей пеÑеноÑимоÑÑÑÑ.
Ðаиболее веÑоÑÑнÑм ÑимпÑомом пеÑедозиÑовки ÑвлÑеÑÑÑ Ð°ÑÑеÑиалÑÐ½Ð°Ñ Ð³Ð¸Ð¿Ð¾ÑензиÑ, обÑÑÐ»Ð¾Ð²Ð»ÐµÐ½Ð½Ð°Ñ Ð°Ð½ÑигипеÑÑензивнÑм дейÑÑвием пÑепаÑаÑа. Рекомендовано ÑимпÑомаÑиÑеÑкое леÑение.
Удаление дейÑÑвÑÑÑÐ¸Ñ Ð²ÐµÑеÑÑв пÑи пÑоведении гемодиализа маловеÑоÑÑно, поÑколÑÐºÑ Ð·Ð½Ð°ÑиÑелÑÐ½Ð°Ñ Ð¸Ñ ÑаÑÑÑ ÑвÑзÑваеÑÑÑ Ñ Ð±ÐµÐ»ÐºÐ°Ð¼Ð¸ Ð¿Ð»Ð°Ð·Ð¼Ñ ÐºÑови.
Применение при беременности
Применение при беременности
ÐаÑиенÑки и паÑиенÑÑ Ñ ÑÐ¾Ñ ÑаненнÑм ÑепÑодÑкÑивнÑм поÑенÑиалом, конÑÑаÑепÑÐ¸Ñ (еÑли пÑименимо)
СледÑÐµÑ Ð¸Ð½ÑоÑмиÑоваÑÑ Ð¿Ð°ÑиенÑок Ñ ÑÐ¾Ñ ÑаненнÑм ÑепÑодÑкÑивнÑм поÑенÑиалом о возможнÑÑ Ð¿Ð¾ÑледÑÑвиÑÑ Ð¿ÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑа во вÑÐµÐ¼Ñ Ð±ÐµÑеменноÑÑи, а Ñакже о Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ð¾ÑÑи иÑполÑÐ·Ð¾Ð²Ð°Ð½Ð¸Ñ Ð½Ð°Ð´ÐµÐ¶Ð½ÑÑ Ð¼ÐµÑодов конÑÑаÑепÑии во вÑÐµÐ¼Ñ Ð»ÐµÑÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑом и в ÑеÑение недели поÑле его поÑледнего пÑиема.
ÐеÑеменноÑÑÑ
Ðак и дÑÑгие пÑепаÑаÑÑ, напÑÑмÑÑ Ð´ÐµÐ¹ÑÑвÑÑÑие на Ð ÐÐС, пÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио не ÑледÑÐµÑ Ð¿ÑименÑÑÑ Ð²Ð¾ вÑÐµÐ¼Ñ Ð±ÐµÑеменноÑÑи. ÐейÑÑвие пÑепаÑаÑа ЮпеÑио опоÑÑедовано блокадой ÑеÑепÑоÑов ангиоÑензина II, поÑÑÐ¾Ð¼Ñ ÑиÑк Ð´Ð»Ñ Ð¿Ð»Ð¾Ð´Ð° нелÑÐ·Ñ Ð¸ÑклÑÑиÑÑ. У беÑеменнÑÑ Ð¶ÐµÐ½Ñин, пÑинимавÑÐ¸Ñ Ð²Ð°Ð»ÑаÑÑан, оÑмеÑалиÑÑ ÑлÑÑаи ÑамопÑоизволÑного пÑеÑÑÐ²Ð°Ð½Ð¸Ñ Ð±ÐµÑеменноÑÑи, Ð¼Ð°Ð»Ð¾Ð²Ð¾Ð´Ð¸Ñ Ð¸ наÑÑÑÐµÐ½Ð¸Ñ ÑÑнкÑии поÑек Ñ Ð½Ð¾Ð²Ð¾ÑожденнÑÑ . ÐÑи наÑÑÑплении беÑеменноÑÑи во вÑÐµÐ¼Ñ Ð»ÐµÑÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑом паÑиенÑке ÑледÑÐµÑ Ð¿ÑекÑаÑиÑÑ Ð¿Ñием пÑепаÑаÑа и пÑоинÑоÑмиÑоваÑÑ Ñвоего леÑаÑего вÑаÑа.
ÐÑÑдное вÑкаÑмливание
ÐеизвеÑÑно, пÑÐ¾Ð½Ð¸ÐºÐ°ÐµÑ Ð»Ð¸ пÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио в гÑÑдное молоко Ñ Ñеловека. ÐоÑколÑÐºÑ Ð² доклиниÑеÑÐºÐ¸Ñ Ð¸ÑÑледованиÑÑ Ð¾ÑмеÑено вÑделение ÑакÑбиÑÑила и валÑаÑÑана Ñ Ð¼Ð¾Ð»Ð¾ÐºÐ¾Ð¼ лакÑиÑÑÑÑÐ¸Ñ ÐºÑÑÑ, не ÑекомендÑеÑÑÑ Ð¿ÑименÑÑÑ Ð¿ÑепаÑÐ°Ñ Ð®Ð¿ÐµÑио в пеÑиод гÑÑдного вÑкаÑмливаниÑ. РеÑение об оÑказе Ð¾Ñ Ð³ÑÑдного вÑкаÑÐ¼Ð»Ð¸Ð²Ð°Ð½Ð¸Ñ Ð¸Ð»Ð¸ об оÑмене леÑÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑом ЮпеÑио и пÑодолжении гÑÑдного вÑкаÑÐ¼Ð»Ð¸Ð²Ð°Ð½Ð¸Ñ ÑледÑÐµÑ Ð¿ÑинимаÑÑ Ñ ÑÑеÑом важноÑÑи его пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð´Ð»Ñ Ð¼Ð°ÑеÑи.
ФеÑÑилÑноÑÑÑ
ÐаннÑÑ Ð¾ влиÑнии пÑепаÑаÑа ЮпеÑио на ÑеÑÑилÑноÑÑÑ Ð¼ÑжÑин и женÑин неÑ. РиÑÑледованиÑÑ Ð¿ÑепаÑаÑа ЮпеÑио Ñ Ð¶Ð¸Ð²Ð¾ÑнÑÑ ÑÐ½Ð¸Ð¶ÐµÐ½Ð¸Ñ ÑеÑÑилÑноÑÑи оÑмеÑено не бÑло.
Детали
| Срок годности | 3 года. Препарат не следует применять после истечения срока годности. |
|---|---|
| Условия хранения | При температуре не выше 25 °С. Хранить в недоступном для детей месте. |
| Производитель | Новартис Нева ООО, Россия |
| Лекарственная форма | таблетки |
| Бренд | Новартис Нева ООО |
Другие формы…
Похожие товары
Купить Юперио, 100 мг 56 шт с доставкой в США, Великобританию, Европу и более 120 других стран.