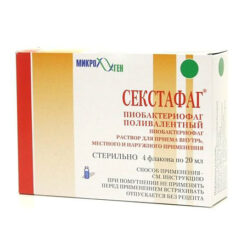
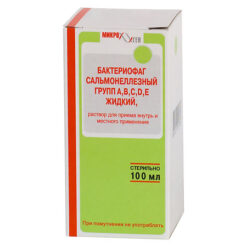
Корзина пуста.
Иларис, лиофилизат 150 мг
€1.00
Нет в наличии
Сообщим когда появится в наличии
Описание
Фармакотерапевтическая группа: Иммунодепрессивное средство – антитела моноклональные к интерлейкину-1β.
Код ATX: L04AC08.
Фармакологические свойства
Механизм действия
Канакинумаб – человеческое моноклональное антитело IgGl/каппа изотипа к интерлейкину-1β (ИЛ-1β). Канакинумаб с высоким аффинитетом связывается с человеческим ИЛ-1β, нейтрализуя, таким образом, его биологическое действие, блокируя взаимодействие ИЛ-1β с его рецепторами, ИЛ-1β-индуцированную активацию генов и продукцию медиаторов воспаления, таких как ИЛ-6 и циклооксигеназа-2. Таким образом, канакинумаб подходит для коррекции заболеваний и состояний, характеризующихся гиперпродукцией ИЛ-1β на местном или системном уровне.
Фармакодинамика
Избыточная продукция ИЛ-1β при воспалительных заболеваниях может приводить к развитию местного или системного воспалительного процесса, избыточной продукции С-реактивного белка (СРБ) или сывороточного амилоида А (САА) и лихорадки.
Криопирин-ассоциированный периодический синдром (cryopyrin-associated periodic syndrome, CAPS)У пациентов с различными фенотипами CAPS, включая семейный холодовой
аутовоспалительный синдром/семейную холодовую крапивницу (Familial Cold Autoinflammatory Syndrome/ Familial Cold Urticaria, FCAS/FCU), Синдром Макла-Уэлъса (Muckle-Wells Syndrome, MWS) и мультисистемное младенческое воспалительное заболевание/хронический младенческий неврологический кожно-артикулярный синдром (Neonatal onset multisystemic inflammatory disease/Chronic infantile neurological cutaneous and articular syndrome, NOMID/C1NCA), с избыточной неконтролируемой продукцией ИЛ-1β (что проявляется лихорадкой, повышенной утомляемостью, кожной сыпью, артритом, выраженным лейкоцитозом, большим количеством тромбоцитов, а также увеличением концентрации СРБ) отмечен быстрый ответ на терапию канакинумабом. На фоне терапии препаратом такие явления как повышенная концентрация СРБ, САА, лейкоцитоз и повышенное количество тромбоцитов быстро возвращались к нормальному уровню.
Болезнь Стилла у взрослых и юношеский артрит с системным началом (системный ювенильный идиопатический артрит, сЮИА, классификация ILAR, международной лиги ревматологических ассоциаций)Болезнь Стилла у взрослых и сЮИА – тяжелые аутовоспалительные заболевания, которые обусловлены врожденным иммунитетом посредством провоспалительных цитокинов, ключевым среди которых является ИЛ-1β.
Общие проявления болезни Стилла взрослых и сЮИА включают лихорадку, кожную сыпь, гепатоспленомегалию, лимфаденопатию, полисерозит и артрит. Лечение препаратом у большинства данных пациентов приводило к быстрому и устойчивому улучшению со стороны суставных и системных проявлений сЮИА со значительным уменьшением количества воспаленных суставов, быстрому разрешению лихорадки и уменьшению концентрации реактантов острой фазы.
Подагрический артрит
Обострение подагрического артрита обусловлено активацией тканевых макрофагов и одновременной гиперпродукцией ИЛ-1β, что приводит к острому воспалительному ответу с выраженным болевым синдромом. Продукция ИЛ-1β провоцируется отложением кристаллов солей мочевой кислоты (мононатрия урат моногидрата) в суставах и окружающих тканях, что приводит к активации комплексов «NALP3-инфламосома». Такие активаторы врожденного иммунитета, как эндогенные агонисты толл-подобных рецепторов, также могут вносить свой вклад в активацию транскрипции гена ИЛ-1β, инициируя обострение подагрического артрита. После терапии канакинумабом в течение короткого времени отмечается снижение концентрации лабораторных маркеров воспаления (СРБ, САА), и исчезают признаки воспаления пораженного сустава (боль, отек, покраснение).
Фармакокинетика
Всасывание
У взрослых пациентов с различными фенотипами CAPS после однократного подкожного (п/к) введения 150 мг канакинумаба время достижения максимальной концентрации (Сmax) составляет около 7 дней. Средний конечный период полувыведения составляет 26 дней. При п/к введении канакинумаба абсолютная биодоступность составляет 66% (популяционный фармакокинетический анализ у пациентов с CAPS, включая детей в возрасте от 2 лет). Параметры фармакокинетики (площадь под кривой «концентрация – время» (AUC) и Сmax) повышаются пропорционально дозе в диапазоне доз от 0,30 до 10,0 мг/кг при внутривенной (в/в) инфузии или при п/к введении (в дозе от 150 до 600 мг).
Распределение
Канакинумаб связывается с сывороточным ИЛ-1β. Объем распределения (Vss) изменяется в зависимости от массы тела.
У пациентов с CAPS Vss составляет 6,2 л при массе тела 70 кг, 5,0 л – у пациентов с синдромом периодической лихорадки (TRAPS, H1DS/MKD, FMF) с массой тела 55 кг, у пациентов с сЮИА – 3,2 л при массе тела 33 кг и у пациентов с подагрическим артритом – 7,9 л при массе тела 93 кг. При п/к введении препарата в течение 6 месяцев в дозе 150 мг каждые 8 недель, в дозе 4 мг/кг каждые 4 недели, 150 мг каждые 12 недель коэффициент кумуляции канакинумаба составляет 1,3, 1,6 и 1,1 соответственно.
Выведение
Клиренс (С1) изменяется в зависимости от массы тела. Для пациентов с CAPS этот показатель составляет 0,17 л/сут при массе тела 70 кг, 0,14 л/сут – у пациентов с синдромом периодической лихорадки (TRAPS, HIDS/MKD, FMF) при массе тела 55 кг, у пациентов с сЮИА – 0,11 л/сут при массе тела 33 кг, у пациентов с подагрическим артритом – 0,23 л/сут при массе тела 93 кг. После учета весовых различий существенной разницы в фармакокинетических свойствах канакинумаба у пациентов с подагрическим артритом, различными фенотипами CAPS, TRAPS, HIDS/MKD, FMF и сЮИА выявлено не было. При повторном применении препарата не наблюдается увеличения С1 или изменений каких-либо других, зависимых от времени фармакокинетических параметров канакинумаба. После коррекции дозы по массе тела не отмечено изменения фармакокинетических показателей в зависимости от возраста и пола.
Фармакокинетика в особых клинических случаях
Пациенты в возрасте младше 18 лет
У пациентов в возрасте от 4 лет и старше после однократного п/к введения препарата в дозе 150 мг или 2 мг/кг 1 раз время достижения Сmax канакинумаба составляет 2-7 дней.
Конечный период полувыведения канакинумаба у пациентов данной категории сходен с таковым у взрослых и составляет от 22,9 до 25,7 дней.
По данным анализа популяционного фармакокинетического моделирования фармакокинетические параметы канакинумаба у детей с CAPS в возрасте от 2 до 4 лет сходны с таковыми у пациентов 4 лет и старше. Дополнительный фармакокинетический анализ показал, что параметры фармакокинетики канакинумаба у 6 детей с CAPS в возрасте младше 2 лет были сходными с таковыми у детей в возрасте старше 2 лет. Фармакокинетические характеристики у пациентов с CAPS, TRAPS, HIDS/MKD, FMF и сЮИА схожи. При п/к введении канакинумаба в дозе 4 мг/кг каждые 4 педели у пациентов с сЮИА значения AUC и Сmax были аналогичны в возрастной группе от 2 до 20 лет.
По данным анализа популяционного фармакокинетического моделирования фармакокинетические параметры канакинумаба у пациентов с сЮИА в возрасте 16-20 лет и возрасте младше 16 лет были схожими. У пациентов с сЮИА в возрасте старше и младше 20 лет расчетная экспозиция канакинумаба в равновесном состоянии при величине дозы 4 мг/кг (максимум 300 мг) были сопоставимы.
У пациентов с синдромом периодической лихорадки (TRAPS, HIDS/MKD, FMF) экспозиция при минимальной концентрации канакинумаба в плазме крови при п/к введении препарата в дозе 2 мг/кг каждые 4 недели сопоставима в возрастных группах у пациентов в возрасте от 2 до 20 лет.
Пациенты в возрасте старше 65 лет
Не было выявлено разницы в фармакокинетических параметрах, основанных на С1 и Vss, у пациентов старшей возрастной группы и пациентов в возрасте менее 65 лет.
Показания
Показания
ÐÑÑовоÑпалиÑелÑнÑе ÑиндÑÐ¾Ð¼Ñ Ð¿ÐµÑиодиÑеÑкой Ð»Ð¸Ñ Ð¾Ñадки:
ÐкÑÐ¸Ð²Ð½Ð°Ñ Ñаза болезни СÑилла, в Ñом ÑиÑле болезни СÑилла взÑоÑлÑÑ (ÐСÐ) и ÑиÑÑемного ÑвенилÑного идиопаÑиÑеÑкого аÑÑÑиÑа (ÑЮÐÐ) Ñ Ð¿Ð°ÑиенÑов Ð¾Ñ 2 Ð»ÐµÑ Ð¸ ÑÑаÑÑе пÑи неадекваÑном оÑвеÑе на ÑеÑÐ°Ð¿Ð¸Ñ Ð½ÐµÑÑеÑоиднÑми пÑоÑивовоÑпалиÑелÑнÑми пÑепаÑаÑами (ÐÐÐÐ) и ÑиÑÑемнÑми глÑкокоÑÑикоÑÑеÑоиднÑми пÑепаÑаÑами. ÐÑепаÑÐ°Ñ ÐлаÑиÑ® можно пÑименÑÑÑ Ð² моноÑеÑапии и в комбинаÑии Ñ Ð¼ÐµÑоÑÑекÑаÑом.
ÐÑÑÑÑй подагÑиÑеÑкий аÑÑÑÐ¸Ñ Ñ ÑелÑÑ Ð»ÐµÑÐµÐ½Ð¸Ñ ÑаÑÑÑÑ Ð¾ÑÑÑÑÑ Ð¿ÑиÑÑÑпов подагÑиÑеÑкого аÑÑÑиÑа и пÑедÑпÑÐµÐ¶Ð´ÐµÐ½Ð¸Ñ ÑазвиÑÐ¸Ñ Ð½Ð¾Ð²ÑÑ Ð¿ÑиÑÑÑпов пÑи неÑÑÑекÑивноÑÑи, непеÑеноÑимоÑÑи или пÑи налиÑии пÑоÑивопоказаний к пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð½ÐµÑÑеÑоиднÑÑ Ð¿ÑоÑивовоÑпалиÑелÑнÑÑ Ð¿ÑепаÑаÑов и/или ÐºÐ¾Ð»Ñ Ð¸Ñина и пÑи невозможноÑÑи пÑÐ¾Ð²ÐµÐ´ÐµÐ½Ð¸Ñ ÑеÑапии повÑоÑнÑми кÑÑÑами глÑкокоÑÑикоÑÑеÑоидов.
Действующее вещество
Действующее вещество
Состав
Состав
Как принимать, дозировка
Как принимать, дозировка
У паÑиенÑов Ñ Ð°ÑÑовоÑпалиÑелÑнÑми ÑиндÑомами пеÑиодиÑеÑÐºÐ¸Ñ Ð»Ð¸Ñ Ð¾Ñадок (CAPS, TRAPS, HIDS/MKD, FMF), а Ñакже болезнÑÑ Ð¡Ñилла, в Ñом ÑиÑле Ñ ÑЮÐÐ ÑеÑÐ°Ð¿Ð¸Ñ Ð¿ÑепаÑаÑом ÐлаÑиÑ® Ð¼Ð¾Ð¶ÐµÑ Ð±ÑÑÑ Ð¸Ð½Ð¸ÑииÑована и пÑоводиÑÑÑÑ ÑолÑко под конÑÑолем вÑаÑа, имеÑÑего опÑÑ Ð´Ð¸Ð°Ð³Ð½Ð¾ÑÑики и леÑÐµÐ½Ð¸Ñ ÑооÑвеÑÑÑвÑÑÑÐ¸Ñ Ð·Ð°Ð±Ð¾Ð»ÐµÐ²Ð°Ð½Ð¸Ð¹. ÐоÑле обÑÑÐµÐ½Ð¸Ñ ÑÐµÑ Ð½Ð¸ÐºÐµ пÑигоÑÐ¾Ð²Ð»ÐµÐ½Ð¸Ñ ÑаÑÑвоÑа, вÑбоÑÑ ÑпÑиÑов и игл, пÑигоднÑÑ Ð´Ð»Ñ Ð¸Ð½ÑекÑии, а Ñакже ÑÐµÑ Ð½Ð¸ÐºÐµ пÑÐ¾Ð²ÐµÐ´ÐµÐ½Ð¸Ñ Ð¿/к инÑекÑии, паÑиенÑÑ Ñ Ð²ÑÑеÑказаннÑми заболеваниÑми или лиÑа, за ними ÑÑ Ð°Ð¶Ð¸Ð²Ð°ÑÑие, могÑÑ ÑамоÑÑоÑÑелÑно вводиÑÑ Ð¿ÑепаÑÐ°Ñ Ð¿Ð¾Ð´ надлежаÑим конÑÑолем (еÑли вÑÐ°Ñ ÑоÑÑÐµÑ ÑÑо Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ñм).
У паÑиенÑов Ñ Ð¿Ð¾Ð´Ð°Ð³ÑиÑеÑким аÑÑÑиÑом ÑеÑÐ°Ð¿Ð¸Ñ Ð¿ÑепаÑаÑом ÐлаÑиÑ® Ð¼Ð¾Ð¶ÐµÑ Ð±ÑÑÑ Ð¸Ð½Ð¸ÑииÑована и пÑоводиÑÑÑÑ ÑолÑко под конÑÑолем вÑаÑа, имеÑÑего опÑÑ Ð¿ÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð±Ð¸Ð¾Ð»Ð¾Ð³Ð¸ÑеÑÐºÐ¸Ñ Ð»ÐµÐºÐ°ÑÑÑвеннÑÑ Ð¿ÑепаÑаÑов; введение пÑепаÑаÑа должно оÑÑÑеÑÑвлÑÑÑÑÑ ÑолÑко медиÑинÑким ÑабоÑником.
ÐÑепаÑÐ°Ñ Ð²Ð²Ð¾Ð´ÑÑ Ð¿/к, вÑбиÑÐ°Ñ ÑÑаÑÑки Ñела Ñ Ð²ÑÑаженной подкожной клеÑÑаÑкой, напÑимеÑ, пеÑеднÑÑ Ð¿Ð¾Ð²ÐµÑÑ Ð½Ð¾ÑÑÑ Ð¶Ð¸Ð²Ð¾Ñа, пеÑеднÑÑ Ð¿Ð¾Ð²ÐµÑÑ Ð½Ð¾ÑÑÑ Ð²ÐµÑÑ Ð½ÐµÐ¹ ÑаÑÑи бедÑа, наÑÑÐ¶Ð½Ð°Ñ Ð¿Ð¾Ð²ÐµÑÑ Ð½Ð¾ÑÑÑ Ð²ÐµÑÑ Ð½ÐµÐ¹ ÑаÑÑи плеÑа или ÑгодиÑÑ (Ñм. Ñаздел Â«Ð£ÐºÐ°Ð·Ð°Ð½Ð¸Ñ Ð¿Ð¾ пÑименениÑ»). Ðо избежание болезненнÑÑ Ð¾ÑÑÑений ÑледÑÐµÑ Ð¼ÐµÐ½ÑÑÑ Ð¼ÐµÑÑо Ð²Ð²ÐµÐ´ÐµÐ½Ð¸Ñ Ð¿Ñи каждой поÑледÑÑÑей инÑекÑии. СледÑÐµÑ Ð¸Ð·Ð±ÐµÐ³Ð°ÑÑ Ð²Ð²ÐµÐ´ÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑа в ÑÑаÑÑки Ñ Ð½Ð°ÑÑÑением ÑелоÑÑноÑÑи кожнÑÑ Ð¿Ð¾ÐºÑовов, облаÑÑи ÑÑибов или Ñ Ð½Ð°Ð»Ð¸Ñием ÑÑпи. СледÑÐµÑ Ð¸Ð·Ð±ÐµÐ³Ð°ÑÑ Ð²Ð²ÐµÐ´ÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑа в ÑÑбÑовÑÑ ÑÐºÐ°Ð½Ñ Ð² ÑвÑзи Ñ Ð²Ð¾Ð·Ð¼Ð¾Ð¶Ð½Ñм Ñнижением ÑкÑпозиÑии канакинÑмаба.
ÐаждÑй Ñлакон пÑепаÑаÑа ÐлаÑиÑ® пÑедназнаÑен Ð´Ð»Ñ Ð¾Ð´Ð½Ð¾ÐºÑаÑного иÑполÑÐ·Ð¾Ð²Ð°Ð½Ð¸Ñ Ñ Ð¾Ð´Ð½Ð¾Ð³Ð¾ паÑиенÑа Ð´Ð»Ñ Ð²Ð²ÐµÐ´ÐµÐ½Ð¸Ñ Ð¾Ð´Ð½Ð¾ÐºÑаÑной дозÑ.
ÐÑиопиÑин-аÑÑоÑииÑованнÑй пеÑиодиÑеÑкий ÑиндÑом (CAPS)
РекомендованнÑе наÑалÑнÑе Ð´Ð¾Ð·Ñ Ð¿ÑепаÑаÑа ÐлаÑиÑ® Ð´Ð»Ñ Ð¿Ð°ÑиенÑов Ñ ÐºÑиопиÑин-аÑÑоÑииÑованнÑм пеÑиодиÑеÑким ÑиндÑомом ÑÐºÐ°Ð·Ð°Ð½Ñ Ð² Ñаб. 1
Таб.1 РекомендованнÑе наÑалÑнÑе Ð´Ð¾Ð·Ñ Ð¿ÑепаÑаÑа ÐлаÑиÑ® Ð´Ð»Ñ Ð¿Ð°ÑиенÑов Ñ ÐºÑиопиÑин-аÑÑоÑииÑованнÑм пеÑиодиÑеÑким ÑиндÑомом
ÐÑепаÑÐ°Ñ Ð²Ð²Ð¾Ð´ÑÑ Ð¿/к, 1 инÑекÑÐ¸Ñ Ñ Ð¸Ð½ÑеÑвалом 8 неделÑ.
ÐÑли пÑи ÑÑаÑÑовой дозе 150 мг или 2 мг/кг не полÑÑен ÑдовлеÑвоÑиÑелÑнÑй клиниÑеÑкий оÑвеÑ, а именно пÑоÑеÑÑ ÑазÑеÑÐµÐ½Ð¸Ñ ÑÑпи и дÑÑÐ³Ð¸Ñ ÑимпÑомов воÑÐ¿Ð°Ð»ÐµÐ½Ð¸Ñ Ð½Ðµ наблÑдаеÑÑÑ Ð² ÑеÑение 7 дней поÑле пеÑвой инÑекÑии пÑепаÑаÑа ÐлаÑиÑ®, возможно пÑоведение вÑоÑой инÑекÑии пÑепаÑаÑа в дозе 150 мг (пÑи маÑÑе Ñела >40 кг) или 2 мг/кг (пÑи маÑÑе Ñела â¥15 кг и â¤40 кг). ÐÑи доÑÑижении в поÑледÑÑÑем полного клиниÑеÑкого оÑвеÑа даннÑм паÑиенÑам Ñекомендовано пÑоводиÑÑ Ð¿Ð¾Ð´Ð´ÐµÑживаÑÑÑÑ ÑеÑÐ°Ð¿Ð¸Ñ Ð¿ÑепаÑаÑом ÐлаÑиÑ® в дозе 300 мг 1 инÑекÑÐ¸Ñ Ñ Ð¸Ð½ÑеÑвалом 8 Ð½ÐµÐ´ÐµÐ»Ñ (пÑи маÑÑе Ñела >40 кг) или 4 мг/кг 1 инÑекÑÐ¸Ñ Ñ Ð¸Ð½ÑеÑвалом 8 Ð½ÐµÐ´ÐµÐ»Ñ (пÑи маÑÑе Ñела â¥15 кг и â¤40 кг).
ÐÑли ÑдовлеÑвоÑиÑелÑнÑй клиниÑеÑкий ÑÑÑÐµÐºÑ Ð½Ðµ наблÑдаеÑÑÑ Ð² ÑеÑение 7 дней поÑле повÑÑÐµÐ½Ð¸Ñ Ð´Ð¾Ð·Ñ, возможно пÑоведение ÑÑеÑÑей инÑекÑии пÑепаÑаÑа ÐлаÑиÑ® в дозе 300 мг (пÑи маÑÑе Ñела >40 кг) или 4 мг/кг (пÑи маÑÑе Ñела â¥15 кг и â¤40 кг).
ÐÑи доÑÑижении в поÑледÑÑÑем полного клиниÑеÑкого оÑвеÑа даннÑм паÑиенÑам Ñекомендовано пÑоводиÑÑ Ð¿Ð¾Ð´Ð´ÐµÑживаÑÑÑÑ ÑеÑÐ°Ð¿Ð¸Ñ Ð¿ÑепаÑаÑом ÐлаÑиÑ®в дозе 600 мг 1 инÑекÑÐ¸Ñ Ñ Ð¸Ð½ÑеÑвалом 8 Ð½ÐµÐ´ÐµÐ»Ñ (пÑи маÑÑе Ñела >40 кг) или 8 мг/кг (пÑи маÑÑе Ñела â¥15 кг и â¤40 кг) 1 инÑекÑÐ¸Ñ Ñ Ð¸Ð½ÑеÑвалом 8 Ð½ÐµÐ´ÐµÐ»Ñ Ð½Ð° оÑновании индивидÑалÑной клиниÑеÑкой оÑенки.
ÐÑли пÑи ÑÑаÑÑовой дозе 4 мг/кг ÑдовлеÑвоÑиÑелÑнÑй клиниÑеÑкий ÑÑÑÐµÐºÑ Ð½Ðµ наблÑдаеÑÑÑ Ð² ÑеÑение 7 дней поÑле пеÑвой инÑекÑии, возможно пÑоведение вÑоÑой инÑекÑии пÑепаÑаÑа ÐлаÑиÑ® в дозе 4 мг/кг. ÐÑи доÑÑижении в поÑледÑÑÑем полного клиниÑеÑкого оÑвеÑа даннÑм паÑиенÑам ÑледÑÐµÑ ÑаÑÑмоÑÑеÑÑ Ð²Ð¾Ð·Ð¼Ð¾Ð¶Ð½Ð¾ÑÑÑ Ð¿Ð¾Ð´Ð´ÐµÑживаÑÑей ÑеÑапии в дозе 8 мг/кг 1 инÑекÑÐ¸Ñ Ñ Ð¸Ð½ÑеÑвалом 8 Ð½ÐµÐ´ÐµÐ»Ñ Ð½Ð° оÑновании индивидÑалÑной клиниÑеÑкой оÑенки.
ÐлгоÑиÑм подбоÑа Ð´Ð¾Ð·Ñ Ð´Ð»Ñ Ð²Ð·ÑоÑлÑÑ Ð¸ деÑей ÑÑаÑÑе 4 Ð»ÐµÑ Ñ Ð¼Ð°ÑÑой Ñела ⥠15 кг пÑедÑÑавлен на ÑиÑ. 1, Ð´Ð»Ñ Ð´ÐµÑей Ð¾Ñ 2 до 4 Ð»ÐµÑ Ñ Ð¼Ð°ÑÑой Ñела â¥7,5 кг <15 кг пÑедÑÑавлен на ÑиÑ. 2.
ÐлиниÑеÑкий опÑÑ Ð¿ÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑа Ñ Ð¸Ð½ÑеÑвалом дозиÑÐ¾Ð²Ð°Ð½Ð¸Ñ Ð¼ÐµÐ½ÐµÐµ 4 Ð½ÐµÐ´ÐµÐ»Ñ Ð¸Ð»Ð¸ в дозе более 600 мг или 8 мг/кг огÑаниÑен.
ÐеÑиодиÑеÑкий ÑиндÑом, аÑÑоÑииÑованнÑй Ñ ÑеÑепÑоÑами к ÑакÑоÑÑ Ð½ÐµÐºÑоза опÑÑ Ð¾Ð»Ð¸ (TRAPS), гипеÑ-IgD-ÑиндÑом/ÑиндÑом деÑиÑиÑа мевалонаÑ-ÐºÐ¸Ð½Ð°Ð·Ñ (HIDS/MKD), ÑÐµÐ¼ÐµÐ¹Ð½Ð°Ñ ÑÑедиземномоÑÑÐºÐ°Ñ Ð»Ð¸Ñ Ð¾Ñадка (FMF)
Ð ÐµÐºÐ¾Ð¼ÐµÐ½Ð´Ð¾Ð²Ð°Ð½Ð½Ð°Ñ Ð½Ð°ÑалÑÐ½Ð°Ñ Ð´Ð¾Ð·Ð° пÑепаÑаÑа Ñ Ð²Ð·ÑоÑлÑÑ
и деÑей в возÑаÑÑе 2 Ð»ÐµÑ Ð¸ ÑÑаÑÑе ÑоÑÑавлÑеÑ:
– 150 мг Ñ Ð¿Ð°ÑиенÑов Ñ Ð¼Ð°ÑÑой Ñела >40 кг;
– 2 мг/кг Ñ Ð¿Ð°ÑиенÑов Ñ Ð¼Ð°ÑÑой Ñела â¥7,5 кг и â¤40 кг.
ÐÑепаÑÐ°Ñ Ð¿ÑименÑÑÑ Ð² виде п/к инÑекÑии каждÑе 4 недели.
ÐÑи оÑÑÑÑÑÑвии ÑдовлеÑвоÑиÑелÑного клиниÑеÑкого оÑвеÑа в ÑеÑение 7 дней поÑле пеÑвой инÑекÑии пÑепаÑаÑа ÐлаÑиÑ® возможно пÑоведение вÑоÑой инÑекÑии пÑепаÑаÑа в дозе 150 мг (пÑи маÑÑе Ñела >40 кг) или 2 мг/кг (пÑи маÑÑе Ñела â¥7,5 кг и â¤40 кг). ÐÑи доÑÑижении в поÑледÑÑÑем полного клиниÑеÑкого оÑвеÑа даннÑм паÑиенÑам Ñекомендовано пÑоводиÑÑ Ð¿Ð¾Ð´Ð´ÐµÑживаÑÑÑÑ ÑеÑÐ°Ð¿Ð¸Ñ Ð¿ÑепаÑаÑом ÐлаÑиÑ® в дозе 300 мг или 4 мг/кг каждÑе 4 недели в виде п/к инÑекÑии.
ÐÑодолжение ÑеÑапии пÑепаÑаÑом Ñ Ð¿Ð°ÑиенÑов без клиниÑеÑкого ÑлÑÑÑÐµÐ½Ð¸Ñ Ð´Ð¾Ð»Ð¶Ð½Ð¾ бÑÑÑ Ð¿Ð¾Ð²ÑоÑно ÑаÑÑмоÑÑено леÑаÑим вÑаÑом.
ÐÐ¾Ð»ÐµÐ·Ð½Ñ Ð¡Ñилла (Ð±Ð¾Ð»ÐµÐ·Ð½Ñ Ð¡Ñилла Ñ Ð²Ð·ÑоÑлÑÑ Ð¸ ÑЮÐÐ Ñ Ð¿Ð°ÑиенÑов в возÑаÑÑе ÑÑаÑÑе 2 леÑ)
Ð ÐµÐºÐ¾Ð¼ÐµÐ½Ð´Ð¾Ð²Ð°Ð½Ð½Ð°Ñ Ð´Ð¾Ð·Ð° Ñ Ð¿Ð°ÑиенÑов Ñ Ð¼Ð°ÑÑой Ñела â¥7,5 кг ÑоÑÑавлÑÐµÑ 4 мг/кг (макÑималÑно до 300 мг) каждÑе 4 недели в виде п/к инÑекÑии. ÐÑодолжение ÑеÑапии пÑепаÑаÑом Ñ Ð¿Ð°ÑиенÑов без клиниÑеÑкого ÑлÑÑÑÐµÐ½Ð¸Ñ Ð´Ð¾Ð»Ð¶Ð½Ð¾ бÑÑÑ Ð¿Ð¾Ð²ÑоÑно ÑаÑÑмоÑÑено леÑаÑим вÑаÑом.
ÐодагÑиÑеÑкий аÑÑÑиÑ
ÐонÑÑÐ¾Ð»Ñ Ð³Ð¸Ð¿ÐµÑÑÑекимии и его опÑимизаÑÐ¸Ñ ÑледÑÐµÑ Ð¿ÑоводиÑÑ Ñ Ð¿Ð¾Ð¼Ð¾ÑÑÑ ÑооÑвеÑÑÑвÑÑÑÐ¸Ñ Ð¿ÑоÑивоподагÑиÑеÑÐºÐ¸Ñ Ð¿ÑепаÑаÑов.
ÐÑименÑÑÑ Ð¿ÑепаÑÐ°Ñ ÐлаÑиÑ® Ð´Ð»Ñ ÑеÑапии пÑиÑÑÑпов обоÑÑÑÐµÐ½Ð¸Ñ Ð¿Ð¾Ð´Ð°Ð³ÑиÑеÑкого аÑÑÑиÑа ÑледÑÐµÑ Ð¿Ð¾ меÑе Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ð¾ÑÑи.
Ð ÐµÐºÐ¾Ð¼ÐµÐ½Ð´Ð¾Ð²Ð°Ð½Ð½Ð°Ñ Ð´Ð¾Ð·Ð° пÑепаÑаÑа Ñ Ð²Ð·ÑоÑлÑÑ ÑоÑÑавлÑÐµÑ 150 мг, пÑепаÑÐ°Ñ Ð²Ð²Ð¾Ð´ÑÑ Ð¾Ð´Ð½Ð¾ÐºÑаÑно п/к во вÑÐµÐ¼Ñ Ð¿ÑиÑÑÑпа подагÑиÑеÑкого аÑÑÑиÑа. ÐÐ»Ñ Ð´Ð¾ÑÑÐ¸Ð¶ÐµÐ½Ð¸Ñ Ð¼Ð°ÐºÑималÑной ÑÑÑекÑивноÑÑи пÑепаÑÐ°Ñ Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ð¾ вводиÑÑ ÐºÐ°Ðº можно ÑанÑÑе поÑле наÑала пÑиÑÑÑпа подагÑиÑеÑкого аÑÑÑиÑа.
ÐаÑиенÑам Ñ Ð¾ÑÑÑÑÑÑвием ÑеÑапевÑиÑеÑкого оÑвеÑа на пеÑвÑÑ Ð¸Ð½ÑекÑÐ¸Ñ Ð½Ðµ ÑледÑÐµÑ Ð²Ð²Ð¾Ð´Ð¸ÑÑ Ð¿ÑепаÑÐ°Ñ Ð¿Ð¾Ð²ÑоÑно. У паÑиенÑов Ñ Ð¿Ð¾Ð»Ð¾Ð¶Ð¸ÑелÑнÑм оÑвеÑом на ÑеÑÐ°Ð¿Ð¸Ñ Ð¿ÑепаÑаÑом пÑи Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ð¾ÑÑи пÑÐ¾Ð´Ð¾Ð»Ð¶ÐµÐ½Ð¸Ñ Ð»ÐµÑÐµÐ½Ð¸Ñ Ð¿Ð¾Ð²ÑоÑное введение пÑепаÑаÑа возможно не Ñанее Ñем ÑеÑез 12 Ð½ÐµÐ´ÐµÐ»Ñ Ð¿Ð¾Ñле пÑедÑдÑÑей инÑекÑии.
ÐÑименение Ñ Ð¾ÑобÑÑ Ð³ÑÑпп паÑиенÑов
ÐаÑиенÑÑ Ð² возÑаÑÑе ÑÑаÑÑе 65 леÑ
Ðе ÑÑебÑеÑÑÑ ÐºÐ¾ÑÑекÑии Ð´Ð¾Ð·Ñ Ð¿ÑепаÑаÑа Ñ Ð¿Ð°ÑиенÑов в возÑаÑÑе ÑÑаÑÑе 65 леÑ.
ÐаÑиенÑÑ Ð² возÑаÑÑе младÑе 18 леÑ
ÐÐµÑ Ð´Ð°Ð½Ð½ÑÑ Ð¿Ð¾ пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑа ÐлаÑиÑ® Ð´Ð»Ñ Ð»ÐµÑÐµÐ½Ð¸Ñ Ð¿Ð¾Ð´Ð°Ð³ÑиÑеÑкого аÑÑÑиÑа Ñ Ð´ÐµÑей и подÑоÑÑков младÑе 18 леÑ.
ÐпÑÑ Ð¿ÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ ÐºÐ°Ð½Ð°ÐºÐ¸Ð½Ñмаба Ñ Ð´ÐµÑей младÑе 2 Ð»ÐµÑ Ð¾Ð³ÑаниÑен по показаниÑм кÑиопиÑин-аÑÑоÑииÑованнÑй пеÑиодиÑеÑкий ÑиндÑом (CAPS), пеÑиодиÑеÑкий ÑиндÑом, аÑÑоÑииÑованнÑй Ñ ÑеÑепÑоÑами к ÑакÑоÑÑ Ð½ÐµÐºÑоза опÑÑ Ð¾Ð»Ð¸ (TRAPS), гипеÑ-IgD-ÑиндÑом/ÑиндÑомом деÑиÑиÑа мевалонаÑ-ÐºÐ¸Ð½Ð°Ð·Ñ (HIDS/MKD), ÑÐµÐ¼ÐµÐ¹Ð½Ð°Ñ ÑÑедиземномоÑÑÐºÐ°Ñ Ð»Ð¸Ñ Ð¾Ñадка (FMF), доÑÑÑпнÑе даннÑе ÑÐºÐ°Ð·Ð°Ð½Ñ Ð² ÑÐ°Ð·Ð´ÐµÐ»Ð°Ñ Â«Ð¤Ð°ÑмакологиÑеÑкие ÑвойÑÑва» и «ÐобоÑное дейÑÑвие», однако ÑекомендаÑии по ÑÐµÐ¶Ð¸Ð¼Ñ Ð´Ð¾Ð·Ð¸ÑÐ¾Ð²Ð°Ð½Ð¸Ñ Ð¾ÑÑÑÑÑÑвÑÑÑ. ÐÐµÑ Ð´Ð°Ð½Ð½ÑÑ Ð¿Ð¾ ÑÑÑекÑивноÑÑи и безопаÑноÑÑи канакинÑмаба Ñ Ð¿Ð°ÑиенÑов Ñ ÑЮÐРмладÑе 2 леÑ.
ÐаÑиенÑÑ Ñ Ð½Ð°ÑÑÑением ÑÑнкÑии поÑек
Ðе ÑÑебÑеÑÑÑ ÐºÐ¾ÑÑекÑии Ð´Ð¾Ð·Ñ Ð¿ÑепаÑаÑа Ñ Ð¿Ð°ÑиенÑов Ñ Ð½Ð°ÑÑÑениÑми ÑÑнкÑии поÑек (опÑÑ ÐºÐ»Ð¸Ð½Ð¸ÑеÑкого пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ñ ÑÐ°ÐºÐ¸Ñ Ð¿Ð°ÑиенÑов огÑаниÑен).
ÐаÑиенÑÑ Ñ Ð½Ð°ÑÑÑением ÑÑнкÑии пеÑени
У паÑиенÑов Ñ Ð½Ð°ÑÑÑениÑми ÑÑнкÑии пеÑени ÑÑÑекÑивноÑÑÑ Ð¸ безопаÑноÑÑÑ Ð¿ÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑа не изÑÑалиÑÑ. Так как канакинÑмаб ÑвлÑеÑÑÑ ÑеловеÑеÑким IgG, пÑедполагаеÑÑÑ, ÑÑо наÑÑÑение ÑÑнкÑии пеÑени не влиÑÐµÑ Ð½Ð° его ÑаÑмакокинеÑикÑ.
Взаимодействие
Взаимодействие
Специальные указания
Специальные указания
ÐпÑÑ Ð¿ÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑа ÐлаÑиÑ® Ñ Ð¿Ð°ÑиенÑов Ñ CAPS без ÑÑÑановленной мÑÑаÑии в NLRP3 гене огÑаниÑен.
ÐейÑÑÐ¾Ð¿ÐµÐ½Ð¸Ñ Ð¸ лейкопениÑ
Ðа Ñоне ÑеÑапии ингибиÑоÑами ÐÐ-1, вклÑÑÐ°Ñ Ð¿ÑепаÑÐ°Ñ ÐлаÑиÑ®, оÑмеÑено ÑазвиÑие нейÑÑопении (абÑолÑÑное колиÑеÑÑво нейÑÑоÑилов ниже 1,5Ã109/л) и лейкопении. Ðе ÑледÑÐµÑ Ð½Ð°ÑинаÑÑ Ð»ÐµÑение пÑепаÑаÑом Ñ Ð¿Ð°ÑиенÑов Ñ Ð½ÐµÐ¹ÑÑопенией или лейкопенией. ÐеÑед наÑалом ÑеÑапии пÑепаÑаÑом ÑледÑÐµÑ Ð¾Ð¿ÑеделиÑÑ ÐºÐ¾Ð»Ð¸ÑеÑÑво лейкоÑиÑов, в Ñом ÑиÑле нейÑÑоÑилов и повÑоÑно оÑениÑÑ Ð´Ð°Ð½Ð½Ñе показаÑели ÑеÑез 1-2 меÑÑÑа. Ð ÑлÑÑае длиÑелÑной или повÑоÑной ÑеÑапии ÑледÑÐµÑ Ð¿ÐµÑиодиÑеÑки конÑÑолиÑоваÑÑ Ð´Ð°Ð½Ð½Ñе показаÑели во вÑÐµÐ¼Ñ Ð»ÐµÑениÑ. ÐÑи вÑÑвлении ÑÐ½Ð¸Ð¶ÐµÐ½Ð¸Ñ Ð°Ð±ÑолÑÑного колиÑеÑÑва нейÑÑоÑилов и лейкоÑиÑов на Ñоне ÑеÑапии пÑепаÑаÑом ÑледÑÐµÑ Ð¾Ð±ÐµÑпеÑиÑÑ Ð½Ð°Ð´Ð»ÐµÐ¶Ð°Ñий конÑÑÐ¾Ð»Ñ ÑоÑÑоÑÐ½Ð¸Ñ Ð¿Ð°ÑиенÑа и пÑи Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ð¾ÑÑи ÑаÑÑмоÑÑеÑÑ Ð²Ð¾Ð¿ÑÐ¾Ñ Ð¾ пÑекÑаÑении леÑÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑом.
ÐлокаÑеÑÑвеннÑе новообÑазованиÑ
ÐмеÑÑÑÑ ÑообÑÐµÐ½Ð¸Ñ Ð¾ ÑлÑÑаÑÑ ÑазвиÑÐ¸Ñ Ð·Ð»Ð¾ÐºÐ°ÑеÑÑвеннÑÑ Ð½Ð¾Ð²Ð¾Ð¾Ð±Ñазований Ñ Ð¿Ð°ÑиенÑов, полÑÑаÑÑÐ¸Ñ Ð¿ÑепаÑÐ°Ñ ÐлаÑиÑ®, однако ÑиÑк ÑазвиÑÐ¸Ñ Ð·Ð»Ð¾ÐºÐ°ÑеÑÑвеннÑÑ Ð½Ð¾Ð²Ð¾Ð¾Ð±Ñазований на Ñоне ÑеÑапии анÑиÑелами, ÑвÑзÑваÑÑими ÐÐ-1, неизвеÑÑен.
ÐнÑекÑионнÑе заболеваниÑ
ÐÑименение пÑепаÑаÑа ÐлаÑиÑ® Ð¼Ð¾Ð¶ÐµÑ ÑопÑовождаÑÑÑÑ ÑвелиÑением ÑаÑÑоÑÑ ÑазвиÑÐ¸Ñ ÑеÑÑезнÑÑ Ð¸Ð½ÑекÑий, поÑÑÐ¾Ð¼Ñ ÑледÑÐµÑ ÑÑаÑелÑно наблÑдаÑÑ Ð¿Ð°ÑиенÑа Ñ ÑелÑÑ Ð²ÑÑÐ²Ð»ÐµÐ½Ð¸Ñ ÑимпÑомов инÑекÑии во вÑÐµÐ¼Ñ Ð¸ поÑле ÑеÑапии пÑепаÑаÑом. СледÑÐµÑ ÑоблÑдаÑÑ Ð¾ÑÑоÑожноÑÑÑ Ð¿Ñи пÑименении пÑепаÑаÑа Ñ Ð¿Ð°ÑиенÑов Ñ Ð¸Ð½ÑекÑиÑми, ÑеÑидивиÑÑÑÑими инÑекÑионнÑми заболеваниÑми в анамнезе или ÑопÑÑÑÑвÑÑÑими заболеваниÑми, пÑедÑаÑполагаÑÑими к ÑазвиÑÐ¸Ñ Ð¸Ð½ÑекÑий. ÐÑи CAPS, TRAPS, HIDS/MKB, FMF и болезни СÑилла леÑение пÑепаÑаÑом ÐлаÑиÑ® не ÑледÑÐµÑ Ð½Ð°ÑинаÑÑ Ð¸Ð»Ð¸ пÑодолжаÑÑ Ñ Ð¿Ð°ÑиенÑов Ñ Ð°ÐºÑивной инÑекÑией, ÑÑебÑÑÑей медиÑинÑкого вмеÑаÑелÑÑÑва. У паÑиенÑов Ñ Ð¿Ð¾Ð´Ð°Ð³ÑиÑеÑким аÑÑÑиÑом не ÑледÑÐµÑ Ð½Ð°ÑинаÑÑ ÑеÑÐ°Ð¿Ð¸Ñ Ð¿ÑепаÑаÑом в акÑивнÑй пеÑиод инÑекÑии. Ðе ÑледÑÐµÑ Ð¿ÑименÑÑÑ Ð¿ÑепаÑÐ°Ñ Ð¾Ð´Ð½Ð¾Ð²Ñеменно Ñ Ð¸Ð½Ð³Ð¸Ð±Ð¸ÑоÑами ФÐÐ, Ñак как ÑÑо Ð¼Ð¾Ð¶ÐµÑ Ð¿ÑиводиÑÑ Ðº ÑвелиÑÐµÐ½Ð¸Ñ ÑиÑка ÑазвиÑÐ¸Ñ ÑеÑÑезнÑÑ Ð¸Ð½ÑекÑий.
ÐÑи пÑименении пÑепаÑаÑа ÐлаÑиÑ® оÑмеÑалиÑÑ ÐµÐ´Ð¸Ð½Ð¸ÑнÑе ÑлÑÑаи оппоÑÑÑниÑÑиÑеÑÐºÐ¸Ñ Ð¸Ð½ÑекÑий (в Ñ.Ñ. аÑпеÑгиллез, аÑипиÑнÑе инÑекÑионнÑе Ð·Ð°Ð±Ð¾Ð»ÐµÐ²Ð°Ð½Ð¸Ñ Ð¼Ð¸ÐºÐ¾Ð±Ð°ÐºÑеÑиалÑной ÑÑиологии, опоÑÑÑваÑÑий лиÑай). Ðевозможно иÑклÑÑиÑÑ Ð¿ÑиÑинно-ÑледÑÑвеннÑÑ ÑвÑÐ·Ñ Ð¼ÐµÐ¶Ð´Ñ Ð´Ð°Ð½Ð½Ñми ÑвлениÑми и пÑименением пÑепаÑаÑа.
ÐÑи пÑименении пÑепаÑаÑа пÑиблизиÑелÑно Ñ 12% паÑиенÑов Ñ ÑазлиÑнÑми ÑеноÑипами CAPS наблÑдалиÑÑ Ð¿Ð¾Ð»Ð¾Ð¶Ð¸ÑелÑнÑе ÑезÑлÑÑаÑÑ ÑÑбеÑкÑлиновой пÑÐ¾Ð±Ñ Ð±ÐµÐ· ÐºÐ°ÐºÐ¸Ñ -либо пÑизнаков ÑÑбеÑкÑлезной инÑекÑии (лаÑенÑной или акÑивной). ÐÐµÑ Ð´Ð°Ð½Ð½ÑÑ Ð¾Ð± ÑвелиÑении ÑиÑка ÑеакÑиваÑии ÑÑбеÑкÑлезной инÑекÑии пÑи леÑении моноклоналÑнÑми анÑиÑелами к ÐÐ-1 (напÑимеÑ, пÑепаÑÐ°Ñ ÐлаÑиÑ®).
ÐеÑед пÑименением пÑепаÑаÑа ÐлаÑиÑ® Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ð¾ обÑледоваÑÑ Ð²ÑÐµÑ Ð¿Ð°ÑиенÑов Ñ ÑелÑÑ Ð²ÑÑÐ²Ð»ÐµÐ½Ð¸Ñ Ð°ÐºÑивной или лаÑенÑной ÑÑбеÑкÑлезной инÑекÑии (вклÑÑÐ°Ñ ÑÐ±Ð¾Ñ Ð°Ð½Ð°Ð¼Ð½ÐµÐ·Ð° и пÑоведение ÑооÑвеÑÑÑвÑÑÑÐ¸Ñ ÑкÑининговÑÑ ÑеÑÑов, напÑимеÑ, ÑÑбеÑкÑлиновой пÑобÑ, ÑеÑÑов IGRA (Interferon-Gamma-Release-Assay) или ÑенÑгенологиÑеÑкого обÑÐ»ÐµÐ´Ð¾Ð²Ð°Ð½Ð¸Ñ Ð¾Ñганов гÑÑдной клеÑки. Ðо вÑÐµÐ¼Ñ Ð¸ поÑле леÑÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑом ÑледÑÐµÑ ÑÑаÑелÑно конÑÑолиÑоваÑÑ ÑоÑÑоÑние паÑиенÑа Ñ ÑелÑÑ Ð²ÑÑÐ²Ð»ÐµÐ½Ð¸Ñ ÑÑбеÑкÑлезной инÑекÑии. СледÑÐµÑ Ð¸Ð½ÑоÑмиÑоваÑÑ Ð¿Ð°ÑиенÑа о Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ð¾ÑÑи обÑаÑаÑÑÑÑ Ðº вÑаÑÑ Ð¿Ñи поÑвлении ÑледÑÑÑÐ¸Ñ ÑимпÑомов на Ñоне и поÑле ÑеÑапии пÑепаÑаÑом ÐлаÑиÑ®: длиÑелÑно ÑÐ¾Ñ ÑанÑÑÑийÑÑ ÐºÐ°ÑелÑ, Ñнижение маÑÑÑ Ñела, ÑÑбÑебÑилÑÐ½Ð°Ñ ÑемпеÑаÑÑÑа. Ð ÑлÑÑае конвеÑÑии ÑÑбеÑкÑлинового ÑеÑÑа из негаÑивного в позиÑивнÑй, оÑобенно Ñ Ð¿Ð°ÑиенÑов вÑÑокого ÑиÑка, Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ð¾ пÑовеÑÑи алÑÑеÑнаÑивнÑе ÑкÑининговÑе ÑеÑÑÑ. ÐÑи вÑÑвлении ÑÑбеÑкÑлезной инÑекÑии леÑение пÑепаÑаÑом ÐлаÑиÑ® не ÑледÑÐµÑ Ð½Ð°ÑинаÑÑ Ð¸Ð»Ð¸ пÑодолжаÑÑ.
СиндÑом акÑиваÑии макÑоÑагов Ñ Ð¿Ð°ÑиенÑов Ñ Ð±Ð¾Ð»ÐµÐ·Ð½ÑÑ Ð¡Ñилла Ñ Ð²Ð·ÑоÑлÑÑ Ð¸ ÑЮÐÐ
СиндÑом акÑиваÑии макÑоÑагов â извеÑÑное жизнеÑгÑожаÑÑее ÑоÑÑоÑние, коÑоÑое Ð¼Ð¾Ð¶ÐµÑ ÑазвиваÑÑÑÑ Ñ Ð¿Ð°ÑиенÑов Ñ ÑевмаÑиÑеÑкими заболеваниÑми, в ÑаÑÑноÑÑи Ñ Ð¿Ð°ÑиенÑов Ñ Ð±Ð¾Ð»ÐµÐ·Ð½ÑÑ Ð¡Ñилла, и ÑÑебоваÑÑ Ð¸Ð½ÑенÑивной ÑеÑапии. ÐÑаÑÑ ÑледÑÐµÑ Ð²Ð½Ð¸Ð¼Ð°ÑелÑно оÑноÑиÑÑÑÑ Ðº ÑимпÑомам инÑекÑии или ÑÑ ÑдÑÐµÐ½Ð¸Ñ ÑеÑÐµÐ½Ð¸Ñ Ð·Ð°Ð±Ð¾Ð»ÐµÐ²Ð°Ð½Ð¸Ñ, извеÑÑнÑми как пÑÑковой Ð¼ÐµÑ Ð°Ð½Ð¸Ð·Ð¼ Ð´Ð»Ñ ÑиндÑома акÑиваÑии макÑоÑагов. ÐаннÑе клиниÑеÑÐºÐ¸Ñ Ð¸ÑÑледований ÑказÑваÑÑ, ÑÑо пÑепаÑÐ°Ñ ÐлаÑиÑ®, по вÑей веÑоÑÑноÑÑи, не ÑвелиÑÐ¸Ð²Ð°ÐµÑ ÑиÑк ÑазвиÑÐ¸Ñ ÑиндÑома акÑиваÑии макÑоÑагов Ñ Ð¿Ð°ÑиенÑов Ñ ÑЮÐÐ, однако, не позволÑÑÑ ÑделаÑÑ Ð¾ÐºÐ¾Ð½ÑаÑелÑнÑÑ Ð²Ñводов.
РеакÑии гипеÑÑÑвÑÑвиÑелÑноÑÑи
ÐÑи пÑименении пÑепаÑаÑа ÐлаÑиÑ® ÑообÑалоÑÑ Ð¾ ÑеакÑиÑÑ Ð³Ð¸Ð¿ÐµÑÑÑвÑÑвиÑелÑноÑÑи. РболÑÑинÑÑве ÑлÑÑаев даннÑе ÑеакÑии бÑли вÑÑÐ°Ð¶ÐµÐ½Ñ Ð² легкой ÑÑепени. ÐÑи пÑименении пÑепаÑаÑа не наблÑдалоÑÑ ÑазвиÑÐ¸Ñ Ð°Ð½Ð°ÑилакÑоиднÑÑ Ð¸Ð»Ð¸ анаÑилакÑиÑеÑÐºÐ¸Ñ ÑеакÑий. Ðднако пÑи пÑименении пÑепаÑаÑа ÐлаÑиÑ® нелÑÐ·Ñ Ð¸ÑклÑÑиÑÑ ÑиÑк ÑазвиÑÐ¸Ñ ÑÑжелÑÑ ÑеакÑий гипеÑÑÑвÑÑвиÑелÑноÑÑи, коÑоÑÑе могÑÑ Ð¾ÑмеÑаÑÑÑÑ Ð¿Ñи инÑекÑионном введении пÑепаÑаÑов белкового пÑоиÑÑ Ð¾Ð¶Ð´ÐµÐ½Ð¸Ñ.
ÐаÑÑÑение ÑÑнкÑии пеÑени
РклиниÑеÑÐºÐ¸Ñ Ð¸ÑÑледованиÑÑ Ð¾ÑмеÑÐµÐ½Ñ ÑÑанзиÑоÑное повÑÑение акÑивноÑÑи пеÑеноÑнÑÑ ÑÑанÑаминаз или конÑенÑÑаÑии билиÑÑбина.
ÐаÑиенÑам, Ñ ÐºÐ¾ÑоÑÑÑ Ð½Ð° Ñоне пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð¿ÑепаÑаÑа ÐлаÑиÑ® Ð²Ð¾Ð·Ð½Ð¸ÐºÐ°ÐµÑ Ð²ÐµÑÑиго, ÑледÑÐµÑ Ð²Ð¾Ð·Ð´ÐµÑжаÑÑÑÑ Ð¾Ñ ÑпÑÐ°Ð²Ð»ÐµÐ½Ð¸Ñ ÑÑанÑпоÑÑнÑми ÑÑедÑÑвами или Ð¼ÐµÑ Ð°Ð½Ð¸Ð·Ð¼Ð°Ð¼Ð¸ до полного иÑÑÐµÐ·Ð½Ð¾Ð²ÐµÐ½Ð¸Ñ Ð´Ð°Ð½Ð½Ð¾Ð³Ð¾ нежелаÑелÑного ÑвлениÑ.
Противопоказания
Противопоказания
ÐÑепаÑÐ°Ñ ÑледÑÐµÑ Ñ Ð¾ÑÑоÑожноÑÑÑÑ Ð¿ÑименÑÑÑ Ñ Ð¿Ð¾Ð¶Ð¸Ð»ÑÑ Ð¿Ð°ÑиенÑов; Ñ Ð¿Ð°ÑиенÑов Ñ ÑеÑидивиÑÑÑÑими инÑекÑиÑми или лÑбÑми ÑоÑÑоÑниÑми в анамнезе, пÑедÑаÑполагаÑÑими к ÑазвиÑÐ¸Ñ Ð¸Ð½ÑекÑий.
Побочные действия
Побочные действия
ÐнÑекÑионнÑе и паÑазиÑаÑнÑе заболеваниÑ: оÑÐµÐ½Ñ ÑаÑÑо – инÑекÑии, в ÑаÑÑноÑÑи, назоÑаÑингиÑÑ, ÑинÑÑиÑÑ (виÑÑÑнÑе), инÑекÑии веÑÑ Ð½Ð¸Ñ Ð´ÑÑ Ð°ÑелÑнÑÑ Ð¿ÑÑей, бÑÐ¾Ð½Ñ Ð¸ÑÑ, гÑипп, инÑекÑии моÑевÑводÑÑÐ¸Ñ Ð¿ÑÑей, гаÑÑÑоÑнÑеÑиÑÑ, панникÑлиÑÑ, пневмонии, ÑаÑингиÑÑ, инÑекÑии ÑÑ Ð°.
Со ÑÑоÑÐ¾Ð½Ñ Ð½ÐµÑвной ÑиÑÑемÑ: ÑаÑÑо – головокÑÑжение/веÑÑиго.
Со ÑÑоÑÐ¾Ð½Ñ ÐºÐ¾ÑÑно-мÑÑеÑной ÑиÑÑемÑ: ÑаÑÑо – Ð±Ð¾Ð»Ñ Ð² Ñпине.
Со ÑÑоÑÐ¾Ð½Ñ ÑиÑÑÐµÐ¼Ñ ÐºÑовеÑвоÑениÑ: ÑаÑÑо – ÑÑомбоÑиÑопениÑ, лейкопениÑ; неÑаÑÑо – нейÑÑопениÑ.
Со ÑÑоÑÐ¾Ð½Ñ Ð¾Ð±Ð¼ÐµÐ½Ð° веÑеÑÑв: ÑаÑÑо – диÑлипидемиÑ; возможно пÑÐµÑ Ð¾Ð´ÑÑее повÑÑение конÑенÑÑаÑии моÑевой киÑлоÑÑ.
Со ÑÑоÑÐ¾Ð½Ñ Ð¾Ñгана ÑлÑÑ Ð° и лабиÑинÑнÑе наÑÑÑениÑ: ÑаÑÑо – головокÑÑжение.
Со ÑÑоÑÐ¾Ð½Ñ Ð¿Ð¸ÑеваÑиÑелÑной ÑиÑÑемÑ: ÑаÑÑо – ÑвоÑа; неÑаÑÑо – гаÑÑÑоÑзоÑагеалÑÐ½Ð°Ñ ÑеÑлÑкÑÐ½Ð°Ñ Ð±Ð¾Ð»ÐµÐ·Ð½Ñ; Ð ÑÑде ÑлÑÑаев на Ñоне ÑеÑапии пÑепаÑаÑом Ñ Ð¿Ð°ÑиенÑов Ñ CAPS оÑмеÑалоÑÑ Ð±ÐµÑÑимпÑомное незнаÑиÑелÑное ÑвелиÑение ÑодеÑÐ¶Ð°Ð½Ð¸Ñ Ð±Ð¸Ð»Ð¸ÑÑбина в ÑÑвоÑоÑке кÑови, не ÑопÑовождаÑÑееÑÑ Ð¿Ð¾Ð²ÑÑением акÑивноÑÑи пеÑеноÑнÑÑ ÑÑанÑаминаз.
Со ÑÑоÑÐ¾Ð½Ñ Ð¿ÐµÑени и желÑевÑводÑÑÐ¸Ñ Ð¿ÑÑей: ÑаÑÑо – повÑÑение ÑÑÐ¾Ð²Ð½Ñ Ð±Ð¸Ð»Ð¸ÑÑбина, повÑÑение акÑивноÑÑи ACT.
ÐллеÑгиÑеÑкие ÑеакÑии: не наблÑдалоÑÑ ÑазвиÑÐ¸Ñ Ð°Ð½Ð°ÑилакÑоиднÑÑ Ð¸Ð»Ð¸ анаÑилакÑиÑеÑÐºÐ¸Ñ ÑеакÑий, однако нелÑÐ·Ñ Ð¸ÑклÑÑиÑÑ ÑиÑк ÑазвиÑÐ¸Ñ ÑÑжелÑÑ ÑеакÑий гипеÑÑÑвÑÑвиÑелÑноÑÑи, коÑоÑÑе могÑÑ Ð¾ÑмеÑаÑÑÑÑ Ð¿Ñи инÑекÑионном введении пÑепаÑаÑов белкового пÑоиÑÑ Ð¾Ð¶Ð´ÐµÐ½Ð¸Ñ.
ÐммÑнологиÑеÑкие ÑеакÑии: 1% – Ñ Ð¿Ð°ÑиенÑов, полÑÑавÑÐ¸Ñ ÐºÐ°Ð½Ð°ÐºÐ¸Ð½Ñмаб по Ð¿Ð¾Ð²Ð¾Ð´Ñ Ð¿Ð¾Ð´Ð°Ð³ÑиÑеÑкого аÑÑÑиÑа, вÑÑвлÑлиÑÑ Ð°Ð½ÑиÑела к канакинÑмабÑ; Ñ Ð¿Ð°ÑиенÑов Ñ CAPS даннÑе анÑиÑела не опÑеделÑлиÑÑ.
ÐбÑие ÑеакÑии: неÑаÑÑо – обÑÐ°Ñ ÑлабоÑÑÑ.
ÐеÑÑнÑе ÑеакÑии: ÑаÑÑо – ÑеакÑÐ¸Ñ Ð² меÑÑе введениÑ.
Передозировка
Передозировка
Применение при беременности
Применение при беременности
Детали
| Срок годности | 3 года. Препарат не применять по истечении срока годности. |
|---|---|
| Условия хранения | Хранить в защищенном от света месте при температуре от 2 до 8 °С. Не замораживать. Хранить в оригинальной картонной пачке. Препарат следует хранить в недоступном для детей месте. |
| Производитель | Новартис Фарма Штейн АГ, Швейцария |
| Лекарственная форма | лиофилизат |
| Бренд | Новартис Фарма Штейн АГ |
Похожие товары
Купить Иларис, лиофилизат 150 мг с доставкой в США, Великобританию, Европу и более 120 других стран.